제주도 손바닥선인장 추출물의 표면소독제로써의 항균효과
Effect of Antimicrobiotic of Opuntia ficus-indica on Surface Disinfection
Article information
Abstract
Purpose: To verify the anti-microbiotic activity and to develop eco-friendly surface disinfectants using the Opuntia ficus-indica extract. Methods: The stem and fruits of the Opuntia cultivated in Jeju Island were extracted with hot water, 70% EtOH and 100% MeOH, respectively. To examine the antimicrobial activity of the extracts, gram positive bacteria (Bacillus subtilis, Staphylococcus aureus), gram negative bacteria (Escherichia coli, Salmonella typhimurium), yeast (Candida albicans), mold (Aspergillus flavus) and antibiotic resistant bacteria (E. coli, S. aureus) were measured to form a clear zone. Results: The antibacterial activity of the fruit extract was higher than that of the stem extract, and the antibacterial activity of the 100% MeOH (FM) extract and the 70% EtOH (FE) extract of the palm cactus fruit was suitable for the surface disinfectant overall, and clear-zone formed even at relatively low concentrations (250 mg/mL). The FM and FE have antibacterial activity against various bacteria, therefore they can be used as disinfectants. Conclusion: The antimicrobial activity of Opuntia ficus-indica extract from Jeju Island by stem and fruit was determined at relatively low concentrations (250 mg/mL). The Opuntia ficus-indica extract will be useful for surface disinfectants dissolving the patients’ bath, oral gargling, and powdered powder in water or ethanol in appropriate concentrations.
서 론
1. 연구의 필요성
소독은 병원성 미생물의 아포(spore) 까지는 사멸시키지 못하나, 병원 미생물의 수를 감소시키거나 약화시켜 감염의 위험을 제거한다[1]. 의료 환경에서 일상적으로 행해지고 있는 소독이 부적적할 경우 감염 전파, 환경의 오염, 사용자에 대한 피해 등의 문제가 발생할 수 있있고, 감염관리에 있어 올바른 소독 및 소독제 사용이 중요하다[2]. 유행 발생의 대부분은 부적절한 소독이나 멸균에 관련된 것으로 보고되고 있다[3]. 특히, 의료기관에서 사용하는 의료기구나 환경은 감염전파의 매개물 역할을 하므로 의료관련 감염을 예방하기 위하여 매개물에 대한 적절한 소독이나 멸균이 필수적이다[4].
의료관련 감염은 의료인의 손이 병원균을 전파하고, 부적절한 손위생이 전염병 발생에 관련이 있다는 보고가 있다[5]. 접촉하는 기구나 일반적인 의료 환경은 직접 감염을 일으키기보다 다제내성균을 포함한 다양한 병원성 미생물을 전파시키는 매개체 역할을 함으로써 간접적으로 감염을 전파시킬 수 있다는 보고가 있다[4,6].
표면 소독이란 의료기관에서 환자가 접촉하는 의료기구나 장비의 표면을 화학적 소독제를 가미하여 환자가 접촉하기 전과 후마다 소독하는 것을 말한다[7]. 환자가 사용하는 침상의 표면 및 난간, 베개 표면 및 문손잡이 표면, 검진시 접촉하는 의료기구 표면을 접촉 전과 후 소독하는 것이 그 예이다[7,8]. 의료기구나 장비의 표면 소독은 비말, 접촉을 통한 감염 예방차원에서 중요하다[7,8]. 표면 소독은 사용한 소독제로 인한 항생제 내성균의 감수성 감소를 유도한다는 보고가 있고, 특히, Methicillin-resistant Staphylococcus Aureus (MRSA), Vancomycin-resistant Enterococcus (VRE) 균에 대해 항균 효과를 보기 위한 연구의 필요성을 제기한 연구가 있다[7-11]. Rutala와 Weber [8]는 환자 치료 영역에서 MRSA 집락 또는 감염된 환자의 표면 소독을 위해 올바른 소독제 사용을 권장했다. 중환자실에서는 MRSA에 감염된 환자의 병실은 하루에 3번, 일반 병동에서는 하루에 한 번 소독 할 것을 권장하고, 오염된 것이 확인될 때는 바로 실시해야 하지만, 표면 소독을 정기적인 일정에 포함하여 얼마나 자주 해야 하는지에 대한 지침이 없어 이에 대한 연구가 필요하다고 하였다. 또한, 혈압 커프, 청진기, 혈액 투석 기계 및 영상 사진 기계와 같은 의료기구 및 장비의 표면 소독시 병원 소독제를 사용하는 것이 합리적이라고 보고하였다[8].
국내 생산되고 있는 손바닥선인장의 항균 활성에 대한 연구는 2000년대 초반부터 활발히 진행되고 있고, 항생제에 내성이 생긴 균에 대해 식물 유래 항균 연구의 필요성이 대두되었다[12-30]. 손바닥선인장 (Opuntia ficus-indica,백년초)는 한국의 남부지방에서 재배되며 제주도와 같이 연평균 기온이 높은 지역이면 어떠한 토양에서도 잘 자라기 때문에 대량 생산이 가능한 작물이다[12]. 손바닥선인장의 항균성은 플라보노이드에 의한 것으로 유추할 수 있는데, 플라보노이드는 주로 폴리페놀의 일종으로 terpenoid 계열로 미생물의 세포막을 파괴하거나, 미생물의 대사 작용에 필수적인 물질에 결합해 성장을 억제한다[23]. 백년초, 손바닥선인장 줄기 추출물의 항생제에 내성이 생긴 균에 항균 효과를 보고하는 연구 결과[17]와 천연 재료 추출물을 통한 친환경적인 표면 소독제 발굴 필요성은 본 연구의 동기가 되었다.
2. 연구 목적
본 연구에서는 제주도산 손바닥선인장, 백년초(Opuntia ficus-indica) 추출물이 표면 소독제로써의 항균 효과가 있는지를 검증하여, 제주도산 손바닥 선인장 추출물이 표면 소독제로써의 사용가능성을 파악하기 위함이다.
연구 방법
1. 연구 설계
본 연구는 제주도산 손바닥선인장의 부위 및 추출용매에 대한 항균 효과를 세균과 진균을 이용한 대조군 비교 실험 연구이다.
2. 연구 대상
제주도산 손바닥선인장 추출물의 부위별(줄기, 열매)과 추출용매 방법(고온가압 증류수 추출, 70% 에탄올 추출, 100% 메탄올 추출)에 따른 항균 효과를 세균 균주(그람 양성균 2종, 그람 음성균 2종), 효모균, 곰팡이를 이용하여, 대조군으로 암피실린(ampicillin)을 사용하여 항균 효과를 비교하였다.
암피실린은 그람 양성균과 그람 음성균에 넓게 항균 활성을 보이지만, 항생제에 내성이 생긴 균에 항균 효과에 한계가 있으므로, 항생제에 내성인 생긴 균에 대한 손바닥선인장 추출물의 항균 효과를 보고자 대조군으로 사용하였다. 암피실린은 박테리아의 세포막 합성을 저해하는 메커니즘으로 살균 효과를 나타내며 넓은 항균 영역을 보유하고 있어서 그람 양성균, 그람 음성균 등에 효과적으로 작용한다[30].
3. 연구 도구
1) 제주도산 손바닥선인장, 백년초(Opuntia ficus-indica)
손바닥선인장은 제주특별자치도 제주시 한림읍 제주선인장마을농가에서 재배한 백년초의 줄기와 열매를 사용하였다. 실험 기간은 2019년 10월부터 2020년 6월에 Ch대학교 생명화학고분자공학과 실험실에서 시행되었다.
2) 세균 균주
실험에 사용한 균주는 그람양성균인 Bacillus subtilis (KCCM 11316), Staphylococcus aureus (KCCM 11764), 그람음성균인 Escherichia coli (KCCM 12119), Salmonella typhimurium (KCTC 1526), 효모균인 Candida albicans (KCTC 7678), 곰팡이인 Aspergillus flavus (KCTC 6633), 항생제 내성균인 Escherichia coli (CCARM 1229), Staphylococcus aureus (CCARM 3108)을 대상 미생물로 선정하였다. 항생제에 내성이 생긴 E. coli는 Ampicillin, Cephalothin, Gentamicin, Norloxacin 약제에 각각 128 μg/mL, 128 μg/mL, 32 μg/mL, 0.25 μg/mL의 최소 저해 농도(minimum inhibitory concentration, MIC)를 가지고 있다. 항생제에 내성이 생긴 S. aureus는 Cephalothin, Ciprofloxacin, Erythromycin, Gentamicin, Norfloxacin, Oxacillin,Teicoplanin, Vancomycin 약제에 각각 128 μg/mL, 8 μg/mL, 128 μg/mL, 128 μg/mL, 0.5 μg/mL, 0.25 μg/ mL, 2 μg/mL, 2 μg/mL의 MIC를 가지고 있다. 구강에 집락하는 균이나, 장에 장착하는 균 등 그람 양성 2종과 그람 음성 2종, 항생제에 내성이 생긴 균으로 손바닥 선인장의 항균성이 있다는 연구 보고[17]가 있는 균을 선정하였다[12-27].
3) 생육저해환, 투명대(Clear zone)
생육저해 효과는 균주 주변에 원형으로 나타나는 투명대인 생육저해환 지름 크기를 측정하였다.
4. 실험 처치
1) 재료 추출
(1) 제주도산 손바닥 선인장 추출
제주도산 손바닥선인장 줄기와 열매를 2 cm 너비로 절단하여 40°C에서 3일 동안 열풍건조 후 분쇄하여 증류수 고온 가압, 70% 에탄올, 100% 메탄올로 추출하였다. 추출된 시료는 추후에 한천배지(agar plate)에 생육하는 미생물에 처리하여 미생물의 생장 저해 측정용 시료로 사용하였다.
(2) 증류수 고온 가압 추출
증류수 고온 가압 추출은 줄기와 열매 건조 분쇄물 25 g을 증류수 500 mL에 침지 후 가압증기멸균기를 사용하여 121°C에서 90분 동안 가압 추출하였다.
(3) 70% 에탄올 추출
70% 에탄올 추출은 줄기와 열매 건조 분쇄물 25g을 70% 에탄올 500 mL에 침지 후 상온(25±2°C)에서 3일 동안 추출하였다.
(4) 100% 메탄올 추출
100% 메탄올 추출은 줄기와 열매 건조 분쇄물 25 g을 100% 메탄올 500 mL에 침지 후 상온(25±2°C)에서 3일 동안 추출하였다. 추출물을 Whatman No. 4를 이용해 여과한 후, 감압농축기를 이용하여 농축 후 사용하였다.
2) 균주 및 배지
(1) 생육 배재
세균 생육배지는 Nutrient broth (NB)와 agar (NA)를 사용하였고, 효모균과 곰팡이 생육배지는 Sabouraud dextrose broth (SDB)와 agar (SDA)를 사용하였다.
(2) 분주 도말
NB에 분양받은 균을 분주하여 24시간 동안 37°C에서 150 rpm으로 배양해 흡광값을 0.5로 맞춘 후 NA 배지에 100 μL를 도말하였다. SDB에 분양받은 효모균 및 곰팡이를 분주하여 24시간동안 24°C에서 150 rpm으로 배양해 흡광값을 0.5로 맞춘 후 SDA 배지에 100 μL를 도말하였다. 각각의 추출물을 100% DMSO [dimethyl sulfoxide]로 용해하여 500 mg/mL 농도로 제조하여, 멸균수로 희석(250 mg/mL, 100 mg/mL, 50 mg/mL)하여 실험하였다. 균주를 도말한 배지 위에 시료를 흡수시킨 종이 디스크를 놓은 후 배양하였다.
3) 세포 독성 평가
세포 독성 여부를 확인하기 위해 [3-(4,5-dimethylthiazol-2-yl) -2-5-diphenyltetrazolium bromide] (MTT) assay 시험법을 사용하였다[22]. 대사 과정이 온전한 세포의 미토콘드리아 내의 탈수소효소가 노란색 수용성 tetrazoliumsalt (MTT)를 비수용성의 짙은 자주색 MTT formazan 결정으로 환원시키는 원리를 이용한 것이다[22]. 실험실 환경에서 사람 대장암 세포(HT29), 소아 간암세포(HepG2) 세포주를 1×104 cells/mL 농도로 1 mL씩 분주하여 배양기에서 24시간 동안 안정화를 시킨 후 시료를 농도별로 처리한 후 24시간 동안 배양하였고, 0.2 mg/mL MTT 용액을 300 μL씩 넣어 1시간 동안 배양기에 방치한 후 상등액을 제거하고 DMSO를 200 μL씩 가하고 1분간 흔들어 formazan을 완전히 용해시킨 후 ELISA Bio-Tek instrument Inc. (Winooski, VT, USA)을 사용하여 540 nm에서 흡광도를 측정하였다.
5. 자료 수집
생육저해환 형성과 항균 활성의 크기는 농도 별로 희석한 추출물을 종이 디스크(paper disc, 8 mm)에 100 μL씩 흡수시키고 24시간 동안 37°C에서 배양한 후, 디스크 주변에 생성된 생육저해환의 크기로 측정하였다. 항균 활성은 액체 배양에서 생육저해 효과를 측정하였다.
대조군으로 암피실린을 증류수로 희석하여 0.1 mg/mL 농도로 제조하여 사용하였다.
MTT 용액이 짙은 자주색으로 바뀌는지 관찰하였다.
6. 자료 분석
디스크 확산법(paper disc method)에 의하여 생육저해환 형성 직경 측정을 2회 실험을 하여, 평균과 오차 범위로 비교하여, 항균 활성 결과를 분석하였다.
7. 윤리적 고려
D시 소재의 K대학교 생명윤리심의위원회 심의 면제 승인(IRB No. KNU 2016-0129)을 받았다.
연구 결과
생육저해환 형성 크기 측정은 2회 실험을 하여, 평균과 오차 범위는 Tables 2, 3에 나타내었다. 최소 저해 농도 250 mg/mL에서 생육 저해환의 지름의 크기(단위: mm)는 다음과 같이 형성되었다. 농도 500 mg/mL에서 생육 저해환이 형성되는 것은 괄호속에 농도를 기재하였다.
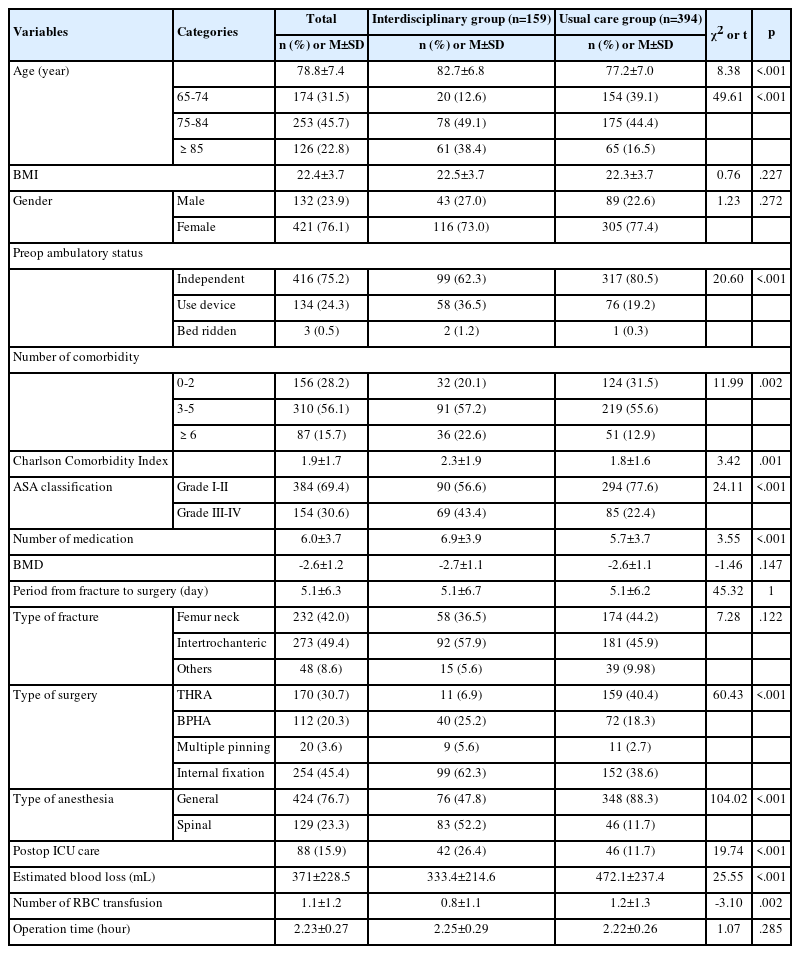
백년초, 손바닥선인장 줄기는 70% 에탄올 추출물(SE)의 생육저해환의 크기가 B. subtilis (9.24±0.85), S. aureus (9.58±0.06), 항생제 내성 S. aureus (10.32±1.02)로 형성되었다(Table 2, Figure 1). 백년초, 손바닥선인장 줄기 증류수 고온 가압 추출물(SW)의 생육저해환의 크기가 S. aureus (9.59±0.38)로 형성되었다(Table 2, Figure 1). 백년초, 손바닥선인장 줄기 100% 메탄올 추출물(SM)의 생육저해환의 크기가 S. aureus (9.73±0.09, 농도 500 mg/mL), 항생제 내성이 생긴 S. aureus (10.07±1.14)로 형성되었다(Table 2, Figure 1).

Opuntia stem extract antibacterial effect picture. SW=Opuntia stem water extract; SE=Opuntia stem 70% ethanol extract; SM=Opuntia stem100% methanol extrac.
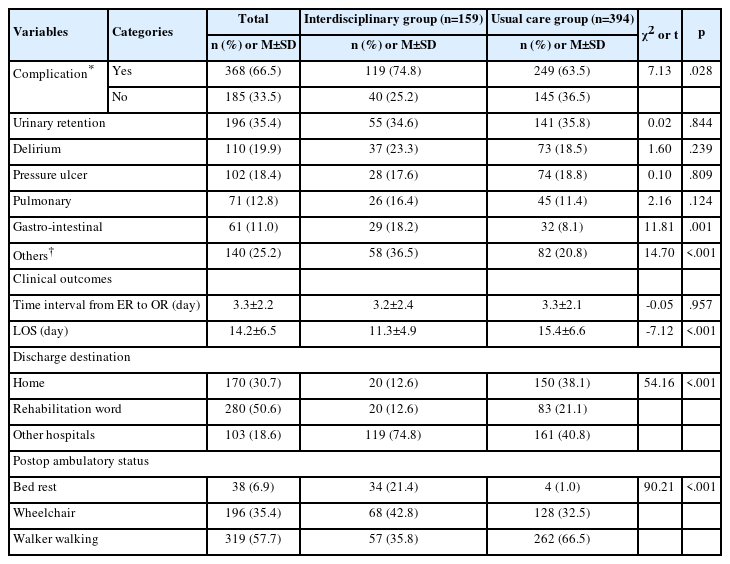
백년초, 손바닥선인장 열매는 100% 메탄올 추출물(FM)의 생육저해환의 크기가 B. subtilis (10.50±0.11), S. aureus (18.68±2.32), E. coli (10.12±0.59), S. typhimurium (11.77±1.65), 항생제 내성이 생긴 E. coli (11.63±3.25 , 농도 500 mg/mL) , 항생제 내성이 생긴 S. aureus (12.51±0.04) 로 형성되었다 (Table 3, Figure 2). 백년초, 손바닥선인장 열매는 증류수 고온 가압 추출물(FW)의 생육저해환의 크기가 B. subtilis (9.43±0.38), S. aureus (16.68±2.32), S. typhimurium (12.19±1.97 , 농도 500 mg/mL), 항생제 내성이 생긴 S. aureus (10.60±0.24 , 농도 500 mg/mL) 로 형성되었다 (Table 3, Figure 2). 백년초, 손바닥선인장 열매 70% 에탄올 추출물(FE)의 생육저해환의 크기가 B. subtilis (11.28±0.62) , S. aureus (15.78±2.78), E. coli (4.85±6.87), S. typhimurium, (10.45±1.53) 항생제 내성이 생긴 E. coli (9.70±0.79,농도 500 mg/mL), 항생제 내성이 생긴 S. aureus (9.55±0.26) 로 형성되었다 (Table 3, Figure 2). FE와 FM은 같은 균주에 대하여 생육저해환을 형성하였다 (Table 3, Figure 2).

Opuntia fruit extract antibacterial effect picture. FW=Opuntia fruit water extract; FE=Opuntia fruit 70% ethanol extract; FM=Opuntia fruit 100% methanol Extract.
세포 독성 평가 결과 SW, SE, SM, FW, FE, FM 별 25-400 μg/mL 농도에 세포 독성이 없는 결과를 얻었다.
논 의
손바닥선인장 줄기와 열매는 총 폴리페놀 화합물과 플라보노이드 함량은 추출방법에 따라 다르며, 총 폴리페놀 화합물의 경우 선인장 열매가 줄기와 씨보다 함량이 높았으며, 총 플라보노이드 함량은 줄기와 열매에서 비슷하다는 연구 결과가 있다[14]. 줄기와 열매의 플라보노이드 함량이 비슷하다는 연구 결과에 의하면, 본 연구에서 항균 활성 효과에도 부위별 차이는 없는 것이 기대되나, 생육 저해환의 크기가 다른 결과는 추출 수율이 FW, FE, SE, FM 순으로 차이가 난 것이 연구 결과에 영향을 미친 것으로 판단된다.
Lee 등 [15]은 천년초, 손바닥 선인장을 에탄올로 추출하여, 아스코르브산, 벤젠 산과 항균 효과를 비교하여 그람양성균 2종(B. subtilis, S. aureus), 그람음성균 3종(E. coli, S. Typhimurium, pseudomonas fluoresens), 효모균 1종(Candida albicans) 총 6개의 병원성 식중독 미생물에 대해 항균 효과를 검토한 결과 그람 양성균과 그람 음성균에 대해 차이가 없는 비슷한 항균효과를 보여 주었으나, 세균에 비해 효모균에서 항균효과는 낮게 나타났다는 보고가 있다[15].
Chung [16]은 백년초, 에탄올 추출물의 7균주에 대한 항균력은 Micrococcus luteus, Bacillus natto, E. coli, B .subtilis, S. aureus, Pseudomonas aeruginosa 순으로 나타났고, Salmonella typhimurium에 대해서는 활성이 미약하였다[16]. 그람양성균 중에서 B. natto, B. subtilis에 대해서는 대조군으로 사용한 벤젠 산 1.0 mg/disc와 비슷한 활성이 인정되었으며 Micrococcus luteus에 대해서는 벤젠 산보다 강력한 활성이 확인되었다는 연구 결과가 있다[16]. 본 연구에서는 백년초, 70% 에탄올로 추출하여 대조군 암피실린과 항균 효과를 비교하여, FE에서 일치하는 결과를 얻었고, SE는 그람 양성균에만 항균 효과를 보이는 결과를 얻었다.
백년초, 손바닥선인장 줄기의 메탄올에서의 추출물은 약제에 내 성이 생긴 MRSA, VRE, vibrio속 세균과, 대장균, 대장균 O-157, 감염형 식중독 원인균, 이질균, 포도 알균, 효모균, 곰팡이에 항균효과가 있다는 연구도 있다[17]. 본 연구에서는 SM가 S. aureus, 항생제 내성이 생긴 S. aureus에 항균활성을 보이는 한편, 모든 추출물이 효모균과 곰팡이에는 저해 효과가 없었다.
Gnanakalai와 Gopal [18]은 백년초, 손바닥선인장의 열매를 물, 에탄 올, 메탄올로 추출하여 B. subtilis, Pseudomonas aeruginoa, E. coli에 대하여 항균활성을 측정한 결과, 메탄올, 에탄올, 물 고온가압 추출물 순서로 항균활성이 높았으며, 본 실험 결과와 일치하였다.
본 연구에서는 FE와 FM은 같은 균주에 대하여 생육저해환을 형성하였다. 표면 소독제로 사용시 인체 안정성을 고려하면 FE가 가장 적합할 것으로 판단된다.
Kim등[19]은 제주도산 손바닥선인장, 백년초(Opuntia ficus-indica var. Saboten Makino) 줄기 분말의 용매추출물 가운데 메틸클로라이드 추출물의 경우 가장 탁월한 항균활성을 나타내었고, 가장 광범위한 항균활성을 나타내는 유효 분획물을 구조 분석한 결과 항균 활성을 나타내는 화합물이 레불린 산(levulinic acid)임을 밝혀냈다[19]. 백년초로부터 분리된 레불린 산은 식품 또는 화장품의 천연 보존제로써 사용 가능하며, 또한, 세균성 질병예방, 항생제로도 사용 가능한 물질임을 밝혀냈다[19].
Lee등[20] 천년초 선인장을 동결 건조 후 손바닥선인장을 70% 에탄올로 추출한 후 항산화 활성이 우수한 에틸아세테이트 분획을 얻은 연구에 의하면 탁시폴린으로 확인된 물질을 가지고 항균 활성을 검증한 결과 그람 양성, 음성의 식중독균에 모두 벤젠 산보다 우수한 활성을 보여주었다. 또한, 4 mg 탁시폴린은 B. subtilis, S. aureus, E. coli, S. Typhimurium, P. fluorescens에 대하여 항균활성을 나타내었다[20]. 탁시폴린은 플라보노이드로서 에탄올 및 메탄올에 용해되고, 물에서는 1.16 mg/mL의 용해도를 갖는다[20].
Kim 등[21]은 100 g 건조 백년초를 70% 에탄올로 추출하여 에탄올층 분획에서 54.4 mg 탁시폴린을 분리하였으며, 백년초 추출물의 항균활성도 확인하였다. 추출 방법에 따라 항생 효과를 얻을 수 있는 물질의 구조가 달라질 수 있으므로, 본 연구에서 항생 효과를 하는 물질은 레불린 산[19] 또는 탁시폴린(Taxifolin) [20], 플라보노이드(chalcone, flavan-3-ol (catechin), flavanone, flavone, flavonal, proantho-cyanidin) 일종[23]일 가능성이 있고, 밝혀지지 않은 새로운 물질인지는 정확한 화학구조를 규명이 필요하다.
본 연구에서는 대조군으로 암피실린을 사용하여, 백년초가 SE, SM, FW, FE, FM이 항생제에 내성이 생긴 S. aureus의 생육을 저해하는 결과를 얻었다. 한편 본 연구에서는 모든 추출물이 효모균과 곰팡이에는 저해 효과가 없었다. 그러므로, 이를 보완할 자외선 소독 등 대책을 마련하는 추후 연구가 필요하다.
제주도산 손바닥선인장, 백년초의 항균 효과를 실험실에서 살펴본 결과 여러 균에 대하여 항균활성을 가지고 있어 천연물을 활용한 소독제로 활용 가능성을 확인해 보았다. 본 연구 결과에서 백년초, 제주도산 손바닥선인장 추출물은 항생제에 내성이 생긴 균에 생육 저해환이 형성되었다는데 의의가 있다.
표면 소독은 가미한 화학적 소독제에 따라 피부와 호흡기 알레르기, 점막 자극(글루테르 알데히드) 인체에 접촉성 알레르기(4급 암모늄), 휘발성(알코올), 인화성(알코올), 각막 손상(알코올), 접촉하는 의료장비의 표면 손상(4급 암모늄)을 유도한다는 보고가 있다[7-11]. FW는 항균성은 지니고, FE보다 휘발성은 없어서 표면 소독할 때 접촉하는 인체 부위의 상호작용으로부터 해로움을 예방할 수 있을 것으로 사료된다. 본 연구 결과 손바닥 선인장 추출물이 세포 독성이 없는 것으로 측정되었지만 병원에서 표면 소독할 경우 표면에 접촉이 닿는 인체에 해로움이 없음을 입증하는 추후 연구가 필요하다. 손바닥선인장 분말 가루를 열수나, 에탄올에 적정 농도에 용해하여, 환자의 침상 목욕이나 구강 가글 및 농반, 후두경, 질경, 초음파 탐침 등 영상의학, 소화기 검진 의료장비 표면 소독, 침전 소독, 표준주의 및 접촉주의 환자의 침상 및 주변, 의료 기구의 소독에 추후 연구가 필요하다. 손바닥 줄기나 열매는 분말 가루 형태로 구할 수 있고, 표면적이 넓은 소독이 필요한 경우에 유용할 수 있다. 실제 병원에서 손바닥선인장 추출물이 휘발성이 적어 인체의 접촉과 흡인으로 인한 점막의 손상과 자극을 줄이고, 접촉하는 의료 장비와 상호작용으로 인한 표면 손상을 방지할 수 있고, 사용 후 폐기가 쉬운 친환경적인 표면 소독제로써 유용하고 인체와의 상호작용 및 의료 장비 표면의 상호작용을 평가하는 연구가 앞으로 요구될 전망이라고 본다.
본 연구는 국내의 천연물을 이용하여 표면 소독제로써의 항균효과를 실험하였고 천연물 활용한 기초자료를 제공할 수 있다는데 의의가 있다.
결 론
본 연구는 제주도산 손바닥선인장 추출물의 부위별과 추출용매방법에 따라 세균과 진균을 이용하여 항균 효과를 확인하였고, 표면 소독제로써 사용 가능성을 확인해 보았다. 손바닥선인장 줄기보다 열매 추출물의 생육저해환을 형성하는 지름의 크기가 더 컸고, 비교적 낮은 농도(250 mg/mL)에서도 생육저해환을 형성하였다. FM과 FE는 그람 양성균, 그람 음성균 , 항생제 내성균에 항균활성을 보였지만, 효모균과 곰팡이에는 항균활성이 없었다. 표면 소독제와 인체의 상호작용을 감안하여, FM 보다 FE가 접촉주의 환자의 침상소독시 FW의 농도 는 최소 500 mg/mL는 되어야 할 것이다.
CONFLICT OF INTEREST
The authors declared no conflict of interest.
AUTHORSHIP
KYR and SHJ contributed to the conception and design of this study; KYR and KDS collected data; KDS performed the statistical analysis and interpretation; KYR drafted the manuscript; KYR, KDS, and SHJ critically revised the manuscript; SHJ supervised the whole study process. All authors read and approved the final manuscript.
ACKNOWLEDEMENTS
논문을 지도해 주신 (고) 나연경 교수님께 감사드립니다.