전자허약지수(electronic frailty index)를 활용한 만성질환 노인의 허약평가와 건강결과 간의 관계: 체계적 고찰
Frailty assessed by the electronic frailty index and its impact on health outcomes in older adults with chronic diseases: a systematic review
Article information
Trans Abstract
Purpose
The electronic frailty index (eFI), which is derived from electronic health records, has been recommended as screening tool for frailty due to its accessibility and ease of use. The objective of this systematic review was to identify the prevalence of frailty assessed by the eFI and its influence on health outcomes in older adults with chronic diseases.
Methods
We searched PubMed, Embase, Web of Science, CINAHL, SCOPUS, Cochrane, Google search, and nursing journals in Korean from January 2016 to December 2022.
Results
Twelve studies were analyzed. The eFI score, based on routine clinical data, was associated with adverse health outcomes. The most frequent outcome studied was mortality, and the eFI was associated with increased mortality in nine studies. Other outcomes studied included hospitalization, length of stay, readmission, and institutionalization in relation to hospital care usage, and cardiovascular events, stroke, GI bleeding, falls, and instrumental activities of daily life as health conditions.
Conclusion
Early identification of frailty in older adults with chronic diseases can decrease the burden of disease and adverse health outcomes. The eFI has a good discriminative capacity to identify frail older adults with chronic diseases.
서론
1. 연구의 필요성
전 세계 65세 이상 노인인구는 9% 이상으로 인구 고령화가 진행되고 있으며 매년 증가 추세를 보인다[1]. 노인인구의 증가는 노화 관련 질병 및 장애의 현저한 증가로 이어져 개인적으로 의료비 지출이 늘어나고 국가적으로 사회경제적 부담을 가중시킨다[1]. 최근 노인의 건강관리에 있어 노인의 허약에 대한 중요성이 대두되고 있다[2]. 노인의 허약은 노화와 관련된 기능적 예비력의 감소로 인해 스트레스에 적응하는 능력이 상실되어 지속적이고 진행적인 기능 상실이 특징이다[2]. 노인의 허약 발생률은 연령에 따라 증가하는 양상을 보이고 있으며 노인인구가 매년 증가 추세인 점으로 미루어 볼 때, 허약 노인은 더욱 증가할 것으로 예상된다[2].
만성질환은 허약의 주요 결정요인으로, 만성질환의 존재는 노인의 허약을 발생시키거나 악화시키는데 중심적 역할을 한다[3]. 만성질환을 가진 노인의 허약은 고령, 저체중, 여성, 교육정도, 음주량, 사회경제적 상태, 동반질환의 존재, 다약제 복용, 인지기능, 신체활동 수준과 관련이 있다[3]. 이러한 복합적 요인들이 축적되어 만성질환 노인의 허약 수준은 더욱 악화되고, 이를 방치하면 부정적인 건강결과를 겪을 위험이 높아진다[4]. 다시 말해서 만성질환 노인은 허약으로 인해 건강한 노인보다 낙상, 골절의 위험과 일상생활동작의 독립성 감소가 더욱 유발되어 비가역적 장애 상태로 전환될 가능성이 커지고, 결국 입원, 입원기간 연장, 재입원 위험이 증가되어 삶의 질이 떨어지고 사망과 같은 치명적인 결과를 더욱 경험하게 된다[5]. 허약을 조기에 식별하여 중재를 적용하면 허약의 진행을 지연시키거나 건강한 상태로 되돌릴 수 있으므로, 부정적인 건강결과를 겪을 위험이 높은 만성질환 노인의 허약평가는 지역사회와 병원 환경 모두에서 중요하다[6]. 허약의 기전은 매우 복잡하고 여러 원인과 관련 요인들이 존재하므로 허약평가를 위한 도구는 다양하며, 각각의 도구에 포함된 항목과 영역의 수가 다르다[7]. 허약평가에 흔히 사용되는 도구들은 허약을 신체적 특징과 관련된 증후군으로 특징지어 임상증상이나 기능이상 정도를 의료진이 직접 확인하거나 자가 보고식 설문지로 구성되어 있다[8,9]. 이 도구들은 에너지 및 예비수준 감소 예측에 유용하지만 주관적인 의견이 반영될 수 있고, 환경에 제약을 받거나 임상 업무량이 추가될 수 있다는 점에서 보편적으로 사용되기 어려운 단점이 있다[9]. 허약을 객관적으로 평가할 수 있으며 빠르고 정확하게 이용할 수 있는 도구의 필요성이 대두됨에 따라 전자의무기록을 이용한 평가도구들이 개발, 발표되기 시작하였다[10]. 전자의무기록 데이터를 이용하여 허약을 평가하는 도구 중 전자허약지수(electronic frailty index, eFI)는 허약을 연령 관련 결손이 축적된 상태로 정의하여 총 건강 지표 수에 대해 발견된 결손의 비율로 허약을 측정하는 방법이다[11]. eFI는 2016년 Clegg 등[11]이 개발한 최초의 허약평가 도구로 전자의무기록을 이용하여 허약과 건강결과 간의 관계를 확인함으로써 사용되기 시작하였고, 최근 캐나다, 호주뿐만 아니라 아시아 지역에서도 eFI를 이용하여 노인의 허약을 평가하고 건강결과와의 관계를 확인한 연구가 활발히 진행되고 있다[12-14]. 이 도구는 전자의무기록에 일상적으로 기록되는 증상, 징후, 진단, 이상 검사, 생활습관 정보와 같은 의료 데이터를 기반으로 하여 허약을 정량화하므로 객관적 평가가 가능하다는 장점을 가진다[11]. 또한 eFI는 대상자의 만성질환뿐만 아니라 기능적 수준까지 고려되어 허약의 특성을 반영하고 있고, 시간이나 노력을 들이지 않고 자동으로 점수가 생성되므로 더 빠르고 정확하게 환자의 허약 수준을 평가할 수 있다[11]. 그러나 최근까지 진행된 선행연구에서 만성질환 노인들의 eFI 활용도는 어떠한지, 어떻게 필요한지 확인한 연구는 찾아보기 어렵다. 만성질환 노인의 건강결과를 예측하고 이에 대한 적절한 개입을 위한 중재를 개발하려면 허약 도구의 선택이 중요하므로, 다차원적인 허약의 특성을 반영하면서 허약평가 도구로서 여러 가지 장점을 가진 eFI에 대해 알아볼 필요가 있다.
허약평가에 대한 임상적 중요성에도 불구하고 아직까지 보편적인 허약 측정기준은 표준화되지 않았고 허약을 평가하기 위한 최적의 모델에 대한 합의가 없으므로 다수의 연구자와 임상 의료인들은 허약평가를 위한 도구의 선택에 있어 유용성에 무게를 둔다[15]. 허약 평가도구에 대한 체계적 고찰 연구 대부분이 허약과 건강결과와의 관계를 확인함으로써 도구의 유용성을 설명하고 있다[16-18]. 문헌의 체계적 고찰 방법은 기존의 일차 연구들의 결과를 종합하여 신뢰할 수 있는 객관적 근거를 제공하는 연구 방법으로 비뚤림이 최소화된 정보를 제공하는데 기여하는 연구 방법이다[19]. 최근까지 만성질환 노인의 허약평가에 eFI의 유용성을 확인한 연구는 찾아보기 어려운 반면 다수의 연구들이 eFI를 이용하여 만성질환 노인의 허약을 평가하고 건강결과를 확인하였다[11,14]. 허약과 건강결과를 체계적으로 고찰함으로써 eFI의 유용성을 확인한 연구는 지역사회 노인을 대상으로 하여 노인의 만성질환 여부를 확인하기 어렵고 건강결과로써 사망률만을 확인하였다[15].
한편, 만성질환 노인은 인구의 고령화로 더욱 증가될 것으로 예상되며 만성질환 노인이 경험하는 신체적 제한, 기능의 상실, 독립성 상실 및 절망감, 사회적 관계의 제한 및 단절은 허약 과 높은 관련성을 가진다는 점에서 만성질환 노인의 허약은 중요하게 다뤄져야 한다[20]. 만성질환 노인의 허약을 적절하게 평가하기 위해 일차의료 및 병원환경 모두에서 허약과 건강결과 간의 연관성에 영향을 미칠 수 있는 신뢰성 있는 도구를 선택할 필요가 있다[6]. 이에 본 연구는 만성질환 노인을 대상으로 eFI를 이용하여 평가한 허약과 건강결과와의 관계를 확인한 연구를 체계적으로 고찰하여 만성질환 노인의 허약과 허약 수준에 대한 건강결과 간의 관계를 확인하고 이를 통해 eFI 유용성을 평가하고자 한다. 본 연구를 통해 만성질환 노인의 허약평가에 관한 eFI 유용성을 확인함으로써 이들에 대한 연구 및 임상 실무에 적합한 허약평가 도구 선택에 근거를 마련하고자 한다.
2. 연구 목적
본 연구의 목적은 만성질환 노인을 대상으로 eFI를 활용한 연구를 통해 허약 발생률을 파악하고 허약에 따른 건강결과를 고찰하여, 허약 평가도구로서 eFI 유용성을 확인하고자 한다.
연구 방법
1. 연구 설계
본 연구는 eFI를 활용한 만성질환 노인의 허약과 건강결과 간의 관계를 확인하기 위한 양적연구 논문들을 검토하고 분석한 체계적 문헌고찰 연구이다.
2. 문헌 선정기준과 제외기준
본 연구의 선정기준은 1) 65세 이상의 노인을 대상으로 한 연구, 2) eFI를 이용하여 허약을 평가한 연구, 3) 만성질환 지표 또는 종류를 명시하여 대상자의 만성질환 여부를 확인한 연구, 4) 허약과 건강 관련 결과를 변수로 제시한 양적연구, 5) 한글 또는 영어로 출판된 연구를 기준으로 하였다. 배제기준은 1) 연구유형이 종설이거나, 체계적 문헌고찰, 메타분석 등 일차문헌이 아닌 연구, 2) 출판되지 않은 학위논문, 연구 프로토콜, 학술 대회 발표 자료 등 전문을 찾을 수 없는 연구, 3) 연구대상에 65세 미만이 포함된 연구이다.
3. 문헌 검색 및 선정
문헌의 검색과 선정 과정은 PRISMA (preferred reporting items for systematic reviews and meta-analysis)의 체계적 문헌고찰 흐름도[21]에 의거하여 진행하였다(Figure 1). 데이터베이스 검색은 국외는 PubMed, Embase, Web of Science, CINAHL, SCOPUS, Google search, 국내는 디비피아(DBpia), 한국교육학술정보원(RISS), 한국 의학 논문 데이터베이스(KMbase), National Digital Science Library (NDSL)를 이용하였다. 데이터베이스 검색 외에도 관련 문헌과 참고문헌을 토대로 수기검색을 병행하여 논문을 검색하였다. 데이터베이스 검색을 통하여 총 2,328편의 논문을 검색하였으며 중복된 892편을 제거하고 남은 1,436편의 문헌의 제목과 초록을 검토하여 623편을 1차 추출하였다. 그 다음 전문이 확보되는 논문 135편을 추출하고 그 중 원문을 검토하여 만성질환을 확인할 수 없는 논문 7편, eFI와 관련이 없는 논문 81편, 건강결과와 관련이 없는 논문 36편, 총 124편의 논문을 제외하였다. 최종적으로 본 연구의 선정기준에 적합한 논문 11편을 확정하고, 수기검색을 통해 확인된 1편의 논문을 포함하여 최종 12편의 분석 대상 논문을 선정하였다 (Appendix 1). 자료의 검색은 허약의 객관적 평가에 대한 필요성이 대두되면서 2016년 eFI가 Clegg 등[11]에 의해 최초로 개발된 점을 고려하여 출판연도 기준으로 2016년 3월부터 2022년 12월까지로 제한하였다. 본 연구의 Participants, Intervention, Comparison, Outcomes (PICO)는 65세 이상의 만성질환 노인(P), eFI로 평가한 허약(I), 건강결과를 측정한 양적연구(O)이다. 검색에 사용된 주요어는 PICO 핵심 질문을 토대로 도구와 관련된(index* or indicator* or indice* or "cumulative deficit*" or "deficit accumulation“), 허약과 관련된("frail" or "frailty" or "frailty elder" or "frailty elderly"), 노인의(older OR "older adult*" OR "older people" OR "geriatric" OR "aged" OR "aging" OR "elder*"), 전자기록의("Medical Records" or "health record" or (EHR or EMR or EPR)을 조합하여 확인하였다. 국문의 경우 ‘노인’, ’허약’, ‘전자의무기록’, ‘허약지수’를 조합하였다. 문헌 선정은 2명(JWS, MYY)의 연구자가 독립적으로 초록 및 전문을 검토하여 문헌 검색 결과를 논의하고 의견이 일치하지 않는 경우 체계적 문헌고찰 연구 경험이 있는 간호학 교수(YJS)와 회의를 거쳐 최종 분석 문헌을 선정하였다. 검색된 문헌은 서지 관리프로그램인 EndNote 20을 이용하여 검토하고 정리하였다.
4. 자료 추출 및 분석
자료 분석은 체계적 문헌고찰 대상 연구의 일반적 특성을 분석한 후 저자명, 출판연도, 국가, 연구목적, 연구설계 및 환경, 표본 수, 나이, 성별과 만성질환 종류, 연구기간, 주요 결과로 포함하였다. 그리고 연구에 포함된 논문의 내용을 추출하여 eFI와 허약 발생률, 그리고 건강결과를 조직화된 표로 구성하였다.
연구 결과
1. 분석대상 논문의 일반적 특성
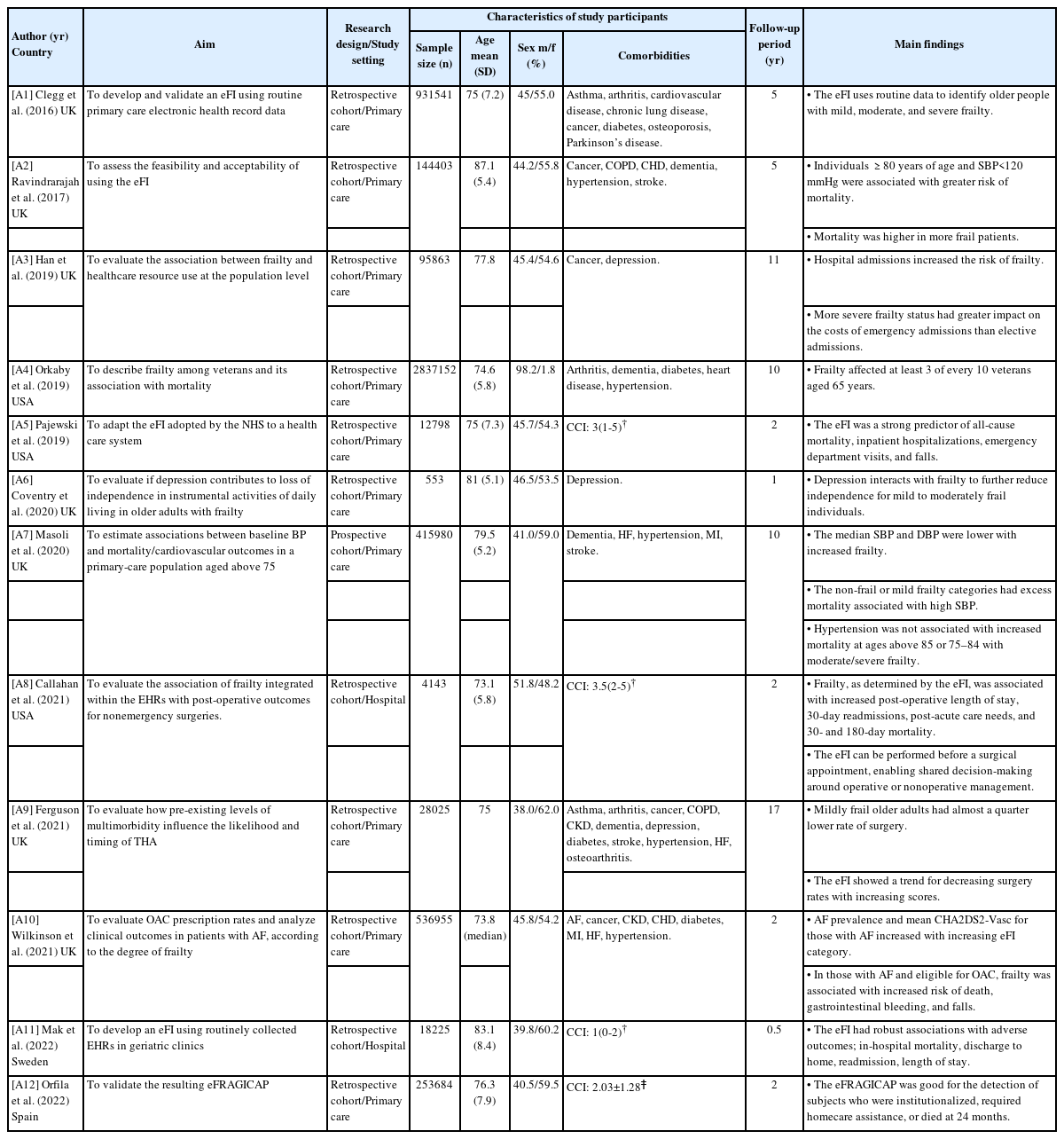
본 연구에서 만성질환 노인의 허약과 건강결과 간의 관계를 파악한 연구 중 최종 선정된 문헌의 일반적 특성은 다음과 같다(Table 1). 분석대상 논문 12편 중 국가를 살펴보면 미국 3편(25.0%), 스웨덴 1편(8.3%), 스페인 1편(8.3%)이었고, 영국이 7편(58.4%)으로 가장 많은 비중을 차지하였다. 대상자 수는 최저 553명부터 최고 2,837,152명까지 다양했고, 평균 연령 범위는 73.2세부터 86.3세로, 9개(75%)의 논문이 70대였다. 성별은 1편(8.3%)만 남성 비율이 98%를 차지하였고, 이를 제외한 11편(91.7%)의 논문은 남성과 여성 비율이 비슷하였다. 연구 방법은 후향적 코호트 연구 11편(91.7%)과 전향적 코호트 연구 1편(8.3%)이었다. 분석대상 연구에서 확인한 노인의 만성질환 종류는 천식, 관절염, 심혈관질환, 폐질환, 암, 당뇨, 파킨슨병과 같이 다양하였고, 우울이 포함되었다. Charlson Comorbidity Index (CCI)를 활용하여 만성질환 여부가 확인된 논문은 4편(30%)이다. CCI는 복합만성질환을 측정하기 위한 지표 중 하나로 점수가 높을수록 복합만성질환의 중증도가 높음을 나타내는데[22], 본 연구 결과 CCI를 이용하여 중위수 또는 평균값을 표기함으로써 대상자의 만성질환 여부를 확인하였다.
2. 문헌의 질 평가
추출된 문헌의 질 평가는 The Newcastle-Ottawa Scale (NOS)를 사용하였다(Table 2). NOS는 체계적 문헌고찰에서 코호트 연구(cohort studies)와 환자-대조군 연구(case-control studies)의 방법론적 질 평가에 흔히 사용되는 도구이다[23]. 각 연구는 8개 항목으로 구성되어, 연구 그룹의 선택, 그룹의 비교 가능성, 연구에 대한 노출 또는 관심결과 확인, 총 3개의 그룹으로 분류된다. 점수는 0점-9점으로 분류된다. 본 연구에서는 NOS 점수가 7점 이상 ‘우수’, 5점 이상 7점 미만 ‘보통’으로 평가하였다. 분석대상 연구에서 5편(41.7%)이 9점을, 7편(58.3%)이 8점으로 나타나 12편의 모든 연구가 ‘우수’한 논문으로 평가되었다. 문헌의 질 평가 과정은 2명(JWS, MYY)의 연구자가 각각 독립적으로 수행한 후 평가 결과가 일치하지 않을 경우, 세번째 연구자(YJS)와의 회의를 통해 재검토하고 적합성 여부를 논의한 후 합의를 도출하였다.
3. eFI를 활용한 허약 발생률
Clegg 등[11]은 eFI를 구성하는 총 결손 수로 36개를 제안하였는데, 본 연구를 통해 eFI를 구성하는 총 결손 수는 수정 도구에 따라 31개부터 54개까지 확인할 수 있었다. 도구의 총 결손 수가 36개인 연구는 7편(58.4%)으로 가장 많았고, 54개는 2편(16.7%)이었고, 31개, 48개, 또는 50개로 구성된 연구는 각 1편씩(8.3%)이었다. 허약 수준은 특정 Cut-off를 이용하여 결정되며, 연구마다 허약의 수준을 분류하는 기준에 차이가 있었다. 본 연구 결과에 따르면, Cut-off를 Fit, Mild, Moderate, Severe, 총 4단계로 구분한 경우 총 9편(75%)으로 가장 많았다. 범위는 8편(66.7%)의 연구에서 ‘0-0.12’, ‘0.13-0.24’, ‘0.25-0.36’, ‘0.36 이상’으로 나누어 허약을 평가하였고(Appendix) [A1-A3,A6,A7,A9,A10,A12], 1편(8.3%)만 다른 기준을 사용하였다 (Appendix) [A11]. 다른 방법으로는 2편(16.7%)의 연구에서 Fit, Pre-frail, Frail, 총 3단계로 구분하여, 각각 ‘0-0.10’, ‘0.11–0.21’, ‘0.21 이상’을 기준으로 허약 수준을 평가하였다(Appendix) [A5,A8]. 그 외 1편(8.3%)의 연구에서 Non-frail, Pre-frail, Mild, Moderate, Severe, 총 5단계로 구분하여 ‘0–0.10’, ‘0.11–0.20’, ‘0.21–0.30’, ‘0.31–0.40’, ‘0.40 이상’을 기준으로 허약수준을 평가하였다(Appendix) [A4]. 본 연구에서 eFI를 이용하여 확인된 노인의 만성질환과 관련된 경증(mild) 또는 전허약(pre-frail) 발생률은 25.0~50.9%로 나타났으며, 중등도 이상의 허약 또는 허약 발생률은 4.3~46.5%로 나타났다. 1편(8.3%)의 연구에서 허약 수준을 비허약(non-frail), 전허약(pre-frail)과 경증(mild), 중등증(moderate), 중증(severe), 총 5단계로 구분한 바(Appendix) [A4], 본 연구에서는 허약 발생률을 확인하기 위해 cut-off 수치를 고려하여 경증(mild) 허약 수준을 전허약(pre-frail)과 구분되는 허약(frail) 상태로 분류하였다(Table 3).
4. eFI를 활용한 허약과 건강결과 간의 관계
본 연구에서 선정된 12편의 연구를 통해 허약과 다양한 건강결과 간의 관계를 확인하였다(Table 3). 가장 빈번한 건강결과는 사망률로 총 9편(75%)의 연구에서 만성질환 노인의 eFI 점수는 모든 원인의 사망률과 관련이 있었다(Appendix) [A1,A2,A4,A5,A7,A8,A10-A12]. 의료 이용과 관련된 건강결과는 입원(Appendix) [A1 ,A3, A5] 3편(25%), 입원 기간 연장(Appendix) [A3,A8,A11] 3편(25%), 재입원(Appendix) [A8,A11] 2편(16.7%), 요양시설 입소(Appendix) [A1,A12] 2편(16.7%), 일차 의료 이용(Appendix) [A3,A12] 2편(16.7%), 그리고 응급실 방문(Appendix) [A5] 1편(8.3%)이 확인되었다. 추출된 문헌에서 확인된 대부분의 건강결과들은 허약 수준의 중증도가 증가함에 따라 부정적인 결과가 나타날 위험이 증가하였으나, 30일 재입원 (Appendix) [A11]은 허약 수준에 따른 차별성을 나타내지 않았다. 건강 상태와 관련된 건강결과는 낙상, 일상생활동작의 독립성, 부정적 심혈관 사건, 위장관 출혈, 고관절 전치환 수술률로 확인되었으며 총 5편(41.7%)에서 포함되었다. 그 중 낙상(Appendix) [A5,A10], 일상생활동작의 독립성(Appendix) [A6]은 허약 수준이 악화될수록 부정적 건강결과로 이어져 차별성을 확인하였다. 부정적 심혈관 사건에 해당하는 뇌졸중은 경구 항응고제를 복용하는 심방세동 노인 환자를 대상으로 한 Wilkinson 등(Appendix) [A10]의 연구에서 허약 수준에 대한 부정적 건강결과로서 차별성이 나타났지만, 노인 환자의 혈압에 대한 허약 수준과 건강결과와의 관계를 확인한 Masoli 등(Appendix) [A7]의 연구 결과 허약 수준에 대해 차별성이 확인되지 않았다. 고관절 골관절염 환자의 고관절치환 수술률은 허약 수준이 악화될수록 수술률이 감소하였다(Appendix) [A9].
논의
본 연구는 만성질환 노인의 허약과 관련된 eFI의 이용 경향을 파악하고 허약과 건강결과 간의 관계를 체계적으로 확인하고자 하였다. 총 12편의 논문을 대상으로 일반적 특성 및 eFI를 이용한 만성질환 노인의 허약 수준과 건강결과와의 관계를 분석하였으며, 측정 도구의 임상적 유용성을 지지하기 위해 주요 연구 결과를 토대로 다음과 같이 논의하고자 한다.
본 연구 결과, eFI는 대부분 영국에서 빈번하게 사용되었고, 미국과 유럽지역에서도 이를 이용한 연구가 활발히 이루어지고 있었다. 이에 더하여 최근에는 중국, 일본과 같은 아시아 지역에서도 eFI를 활용하여 노인의 허약을 스크리닝하기 시작하였다[14,24]. eFI 활용 증가 추세는 건강서비스 제공을 위한 자료수집에 있어 전자의무기록의 역할이 증가하고 있고, 업무 부담과 교육 요구 사항이 수반되지 않고 환자 정보를 신속하고 자동으로 포함할 수 있기 때문으로 판단된다[25]. 그러나 여전히 국내를 포함한 아시아 지역의 활용도는 낮은 편이므로 아시아 지역에서 eFI가 보편적으로 사용되기 위해서는 허약과 건강결과와의 관계를 확인하기 위한 다양한 시도가 필요하다.
본 논문에서 추출된 12편의 논문 중 10편(83.3%)이 일차 의료기관을 이용하는 지역사회 노인들을 대상으로, 나머지 2편(16.7%)은 입원 환자를 대상으로 하였다. 대부분의 논문이 지역사회 노인들을 대상으로 한 점은 Clegg 등[11]이 eFI를 지역사회 노인을 대상으로 개발하였기 때문에 이후 연구자들이 일차 의료를 이용하는 지역사회의 만성질환 노인들을 대상으로 도구를 적용한 것으로 보여진다. 입원 환자의 경우 일상적인 병원 입원 데이터는 더욱 풍부한 자료를 제공하므로 더욱 정확하게 결손 여부를 확인할 수 있으므로 입원 환자의 허약 평가에서 eFI 적용은 유용할 수 있다[26]. 그러나 eFI 특성상 건강 수준이 급성으로 변화하는 경우 이를 허약점수에 반영하기 어려워 주로 장기적인 예후 평가에 사용되므로 입원 환자의 퇴원 후 임상 결과 평가에 대한 변별력을 확인하기 어려운 점은 도구 사용 시 고려해야 한다[26].
eFI는 허약 수준에 대하여 주어진 컷오프 기준에 따라 경증(mild), 중등증(moderate), 중증(severe) 또는 전허약(pre-frail)과 허약(frail)으로 구분하였다. 본 연구에서 만성질환 노인의 전허약(pre-frail) 발생률은 25.0%~50.9%로 지역사회 노인들의 경우 30% 내외였고, 입원한 만성질환 노인의 경우 50.9%로 높은 비율을 차지하였다. 허약 발생률은 사용된 허약 도구나 대상자 모집 환경에 따라 다양하게 나타나므로 비교하기는 어렵지만, 허약 발생률을 체계적으로 고찰한 선행연구에서 노인의 전허약 발생률은 30%-36%로 나타나 본 연구 결과와 유사하였다[6,27]. 전허약(pre-frail) 또는 경증(mild) 허약은 조기 식별과 중재를 통해 건강한 상태로 다시 전환될 가능성이 높은 상태를 의미한다[27]. 비허약 노인으로부터 전허약 만성질환 노인의 구분에 있어 eFI는 임상적 판단력을 기반으로 하는 CFS (Clinical Frailty Scale)나 Fried 표현형 도구보다 더 차별성을 나타내며 건강결과의 위험을 효과적으로 예측할 수 있다[28]. eFI를 활용한 전허약 만성질환 노인의 식별은 만성질환 노인의 허약과 관련된 위험 및 장기적인 부작용을 효과적으로 감소시키고 건강과 삶의 질 개선을 위한 시기 적절한 개입이 가능하도록 중재를 계획하는데 도움이 될 것이다. 그러나 eFI가 가지고 있는 이론적 배경에 의해 만성질환 노인들의 허약 수준을 과대평가할 수 있으므로 불필요한 의료 자원의 낭비를 초래할 수 있는 가능성에 대한 고려가 필요하다[26]
eFI는 만성질환을 허약의 중요한 구성요소로 여기고 있으며, UK National Institute for Health and Care Excellence multimorbidity guidelines는 만성질환 노인 관리를 위해 고려해야 할 조건으로 허약을 언급하며 eFI의 사용을 권장하고 있다[29]. 본 연구 결과 분석대상 논문 12편 중 8편(66.7%)은 만성질환의 종류를 명시하였고 4편(33.3%)은 CCI를 이용하여 노인의 만성질환을 확인함으로써 만성질환 노인의 허약평가에 eFI를 활용하였음을 확인하였다. 만성질환 노인의 질병 관리는 근본적인 치료와 케어보다는 장기적으로 관리하면서 질병 악화와 합병증을 예방하고 남은 기능을 유지하는데 목적이 있으며 이들의 만성질환 치료에 허약 수준을 고려한다면 만성질환의 진행을 늦추고 부정적 건강결과의 발생을 감소시킬 수 있을 것이다[30]. 그런데 만성질환 노인의 치료로 흔히 사용되는 약리학적 방법, 특히 이뇨제, 혈당강하제, 항고혈압제 등의 약물은 투여만으로도 허약이 가중된다[31]. 본 연구 결과를 통해 노인 고혈압 환자의 경우 허약과 사망 위험의 관계는 수축기 혈압 수준에 따라 다르게 나타나 고혈압 환자의 항고혈압제 복용에 있어 허약 수준에 따른 주의 깊은 관찰이 필요하다고 하였다. 노인 심방세동 환자에서 경구용 항응고제 처방은 허약 환자에서 더 일반적으로 이루어지고 있었는데, 허약 노인일수록 사망, 위장관 출혈 및 낙상 위험이 더 높다는 점을 고려할 때 경구용 항응고제 처방은 허약 수준을 고려할 필요가 있다고 하였다. 또한, 우울은 허약과 상호작용하여 허약 수준이 심각할수록 일상생활활동의 독립성을 더욱 감소시켰다. 노인의 우울은 허약과 양방향 연관성을 가지고 있으므로 허약에 대한 임상 관리에서 신체적, 정신적 건강 관리를 통합해야 할 필요가 있다[32]. 이러한 결과들은 만성질환 노인을 대상으로 CFS나 Fried 표현형 도구를 이용하여 허약과 건강결과 간의 관계를 확인한 선행연구 결과와 일치한다[32,33].
eFI와 만성질환 노인의 건강결과 간의 관계를 살펴본 결과, 사망률 뿐만 아니라 의료 이용 측면과 건강 상태 측면에서 상관관계를 확인할 수 있었다. 만성질환 노인 환자의 높은 eFI 점수가 부정적 건강결과로 반드시 이어진다고 해석하기는 어렵지만, eFI가 총체적으로 건강 위험 지표 역할을 하고 있다고 판단할 수 있다. 여러 가지 변수 중 사망률은 허약에 대한 대표적인 건강결과 변수로 사용된다[15]. 추출된 문헌 중 9편(75%)의 연구에서 허약 수준의 중증도에 따라 사망 위험이 증가하는 차별성을 보임으로써 eFI가 만성질환 노인의 허약평가에 유용한 도구임을 확인하였다. 특히, 만성질환 노인의 혈압 수준에 따른 허약 수준별 사망률을 확인한 연구에서 기준혈압보다 낮은 수준에서 허약과 사망률과의 상관관계를 확인하여 낮은 수축기 혈압 노인에서 허약 수준이 악화될수록 사망 위험 증가와 관련이 있음을 확인하였다. 허약 노인의 경우 자율신경 기능과 바로반사 민감도가 감소되어 신체 적응력이 떨어지고 낮은 혈압을 유발하는 여러 만성질환을 앓을 가능성이 더 높기 때문에 사망 위험이 증가하는 것으로, 본 연구 결과는 다른 허약 도구를 이용한 연구 결과와 일맥상통한다[34]. 그러나 아직까지 혈압과 사망률과의 연관성에 대한 허약의 역할에 근거가 부족하며 연구 결과 간의 불일치가 남아있다[35]. 혈압 수준에 따른 eFI와 사망률과의 관계에서 일관성과 타당성에 대한 심도있는 연구가 필요하다.
허약 수준이 중증일수록 만성질환 노인의 일차 의료 이용과 응급실 방문이 증가하고 병원 입원, 입원 기간 증가, 입원 환자의 퇴원 후 30일 이내 재입원으로 이어진다[36]. 본 연구에서도 허약 수준의 중증도에 따른 의료이용 결과가 동일하게 나타나 만성질환 노인의 허약과 의료이용에 대한 eFI의 유용성이 확인되었다. 그런데 Mak 등(Appendix) [A11]의 연구 결과에서 30일 재입원에 대한 차별성이 나타나지 않은 점은 이차 자료를 이용한 대부분의 다른 연구들과는 달리 일개 병원에서 입원 환자를 대상으로 한 연구로 다른 병원에 재입원한 경우 이에 대한 자료를 반영하지 않았기 때문으로 보여진다. 이는 재입원을 예측하는 허약에 대한 선행연구에서 흔히 확인되는 결과이다[37,38]. eFI는 병원 기반 전자의무기록이나 행정 전자 데이터베이스를 모두 이용할 수 있어 다양한 의료 환경에서 허약을 간편하게 객관적으로 평가할 수 있다는 장점이 있지만, 입원 환자와 같이 제한된 범위의 환자 데이터를 이용할 경우 건강결과 변수로써 30일 재입원은 eFI를 활용한 양적연구 계획시 신중히 고려되어야 한다.
허약에 대한 건강결과 변수로 요양시설 입소는 2편(16.7%)이 포함되었으며 만성질환 노인의 허약 수준 악화는 요양시설 입소 위험 증가와 관련이 있었다. 요양시설 입소는 기능 저하 또는 의존 상태의 노인이 허약이 진행됨에 따라 의학적 치료의 복잡성이 증가하고 간병인 지원이 필요할 때 이용하게 되는 자원으로 대부분의 요양시설 입소 노인들은 허약 상태로 예상할 수 있다[39]. eFI는 기능적 수준과 만성질환을 건강 지표로 포함하고 있어 요양원 입소 위험이 다른 도구들보다 높게 나타나므로 요양시설 입소에 대한 예후적 가치가 다른 허약도구에 비해 강하지 않을 수 있다[39]. 만성질환 노인의 허약수준과 요양시설 입소 간의 관계에 대해 다른 평가 도구를 이용하여 결과의 차이를 확인할 수 있는 후속 연구를 제안한다.
eFI와 건강상태 측면에서 건강결과의 관계를 살펴보면, eFI를 이용하여 허약 수준이 고관절 골관절염 노인의 선택적 수술에서 수술 의사결정에 영향을 미칠 수 있다는 점을 확인한 것은 흥미롭다. 고관절 골관절염 노인들은 만성질환 수가 증가할수록 허약 수준이 악화될수록 수술률이 낮았다. 만성질환 노인 환자의 허약 수준은 수술 또는 비수술적 관리에 대한 의사 결정시 중요한 정보가 될 수 있으며, 간호 현장에서 만성질환 노인의 허약 수준별 관찰 및 상담을 제공하는데 eFI 활용의 필요성을 강조할 수 있을 것이다.
본 연구 결과를 종합해볼 때, eFI는 만성질환 노인의 허약에 대해 광범위한 평가와 효과적인 개입이 필요한 경우 조기발견 및 중증도에 따른 식별을 촉진하여 맟춤형 간호를 제공하는데 근거자료로 사용될 수 있다. 이는 만성질환 노인의 기능 저하, 부정적 건강결과의 시작을 예방, 지연시킴으로써 삶의 질 향상을 기대할 수 있으며 합리적인 의료비용 지출에 기여할 것이다. 본 연구의 제한점은 첫째, 만성질환 노인을 대상으로 eFI를 활용한 건강결과와의 관계를 확인한 코호트 연구만으로 구성되었음에도 불구하고, 각각의 건강결과에 대해 추출된 연구 수가 적어 분석 결과의 정밀도가 높지 않을 수 있고 허약 수준을 구분하는 분류 방식과 기준점이 달라 분석대상 논문 결과들의 통계적 합성을 하기 어려워 포괄적인 메타분석을 수행하지 않았다. 그럼에도 불구하고 본 연구는 eFI로 확인한 허약 수준이 만성질환 노인의 전반적인 건강결과에 차별성을 제공한다는 일반적 이해를 제공한다. 둘째, 만성질환 노인을 대상으로 의료진 평가를 기반으로 한 허약 평가도구와 eFI와의 연관성을 직접 평가하지 않아 허약 발생률과 결과 변수에 미치는 영향을 종합하는 것이 어렵다는 점이다. 이에 만성질환 노인을 대상으로 상관관계를 고려한 eFI와 다른 허약 평가도구들과의 예측 유효성을 비교하기 위한 추가 연구가 이루어져야 할 것이다.
결론 및 제언
만성질환 노인의 허약 중증도는 사망률 뿐만 아니라 일차의료 방문, 입원, 입원기간 연장, 30일 재입원, 응급실 방문, 또는 요양시설 입소와 같은 의료 이용과 낙상, 심부전, 뇌졸중, 일상생활수행과 같은 건강 상태와 관련된 결과에서 위험 증가와 관련이 있었다. 본 연구는 eFI를 활용하여 만성질환 노인의 허약 수준과 건강결과 간의 상관관계를 확인함으로써 만성질환 노인에 대한 eFI의 예측 유용성을 확인하였다는데 의의가 있다. 본 연구의 결과는 간호 연구 측면에서 만성질환 노인의 허약 수준에 따른 건강결과를 포괄적으로 이해하는데 도움을 주며, 향후 만성질환 노인의 허약 수준에 따른 간호 중재 개발에 활용될 수 있다. 간호 실무 측면에서 만성질환 노인의 허약 측정에 적합한 도구 선택에 근거를 마련하고, 만성질환 노인의 건강관리에 허약을 적용하기 위한 근거와 방향성을 제공할 수 있다. 또한 노인의 만성질환을 고려한 허약 수준별 맞춤형 간호의 근거를 제공함으로써 간호의 질적, 양적 수준을 향상시키는데 기여할 수 있다. 추후 연구로 eFI를 사용하여 허약의 객관적인 건강결과를 측정할만한 인력이나 연구 장비 등의 제한을 극복하고 장기간에 걸쳐 조사하는 대규모 전향적 코호트 연구 촉진을 제언한다.
Notes
CONFLICT OF INTEREST
The authors declared that no conflict of interest.
AUTHORSHIP
JWS and YJS contributed to the conception and design of this study; JWS collected data; JWS and MYY performed the statistical analysis and interpretation; JWS and MYY drafted the manuscript; JWS, MYY and YJS critically revised the manuscript; JWS and YJS supervised the whole study process. All authors read and approved the final manuscript.
FUNDING
None.
DATA AVAILABILITY
Please contact the corresponding author for data availability.
References
Appendices
Appendix. Studies included in systematic review
A1. Clegg A, Bates C, Young J, Ryan R, Nichols L, Ann Teale E, et al. Development and validation of an electronic frailty index using routine primary care electronic health record data. Age and Ageing. 2016;45(3):353-360. https://doi.org/10.1093/ageing/afw039
A2. Ravindrarajah R, Hazra NC, Hamada S, Charlton J, Jackson SHD, Dregan A, et al. Systolic blood pressure trajectory, frailty, and all-cause mortality >80 years of age: cohort study using electronic health records. Circulation. 2017;135(24):2357-2368. https://doi.org/10.1161/CIRCULATIONAHA.116.026687
A3. Han L, Clegg A, Doran T, Fraser L. The impact of frailty on healthcare resource use: a longitudinal analysis using the clinical practice research datalink in England. Age and Ageing. 2019;48(5):665-671. https://doi.org/10.1093/ageing/afz088
A4. Orkaby AR, Nussbaum L, Ho YL, Gagnon D, Quach L, Ward R, et al. The burden of frailty among U.S. veterans and its association with mortality, 2002-2012. The Journals of Gerontology Series A. 2019;74(8):1257-1264. https://doi.org/10.1093/gerona/gly232
A5. Pajewski NM, Lenoir K, Wells BJ, Williamson JD, Callahan KE. Frailty screening using the electronic health record within a medicare accountable care organization. The Journals of Gerontology Series A. 2019;74(11):1771-1777. https://doi.org/10.1093/gerona/glz017
A6. Coventry PA, McMillan D, Clegg A, Brown L, van der Feltz-Cornelis C, Gilbody S, et al. Frailty and depression predict instrumental activities of daily living in older adults: a population-based longitudinal study using the CARE75+ cohort. PLoS One. 2020;15(12):e0243972. https://doi.org/10.1371/journal.pone.0243972
A7. Masoli JAH, Delgado J, Pilling L, Strain D, Melzer D. Blood pressure in frail older adults: associations with cardiovascular outcomes and all-cause mortality. Age and Ageing. 2020;49(5):807-813. https://doi.org/10.1093/ageing/afaa028
A8. Callahan KE, Clark CJ, Edwards AF, Harwood TN, Williamson JD, Moses AW, et al. Automated frailty screening at-scale for pre-operative risk stratification using the electronic frailty index. Journal of the American Geriatrics Society. 2021;69(5):1357-1362. https://doi.org/10.1111/jgs.17027
A9. Ferguson R, Prieto-Alhambra D, Peat G, Delmestri A, Jordan KP, Strauss VY, et al. Influence of pre-existing multimorbidity on receiving a hip arthroplasty: cohort study of 28025 elderly subjects from UK primary care. BMJ Open. 2021;11(9):e046713. https://doi.org/10.1136/bmjopen-2020-046713
A10. Wilkinson C, Clegg A, Todd O, Rockwood K, Yadegarfar ME, Gale CP, et al. Atrial fibrillation and oral anticoagulation in older people with frailty: a nationwide primary care electronic health records cohort study. Age and Ageing. 2021;50(3):772-779. https://doi.org/10.1093/ageing/afaa265
A11. Mak JKL, Hagg S, Eriksdotter M, Annetorp M, Kuja-Halkola R, Kananen L, et al. Development of an electronic frailty index for hospitalized older adults in Sweden. The Journals of Gerontology Series A. 2022;77(11):2311-2319. https://doi.org/10.1093/gerona/glac069
A12. Orfila F, Carrasco-Ribelles LA, Abellana R, Roso-Llorach A, Cegri F, Reyes C, et al. Validation of an electronic frailty index with electronic health records: eFRAGICAP index. BMC Geriatrics. 2022;22(1):404. https://doi.org/10.1186/s12877-022-03090-8