이식형 심장 모니터링 장치 관련 감염의 위험요인
Risk Factors for Cardiac Implantable Electronic Device-Related Infections
Article information
Abstract
Purpose: This study aimed to investigate the risk factors for cardiac implantable electronic device (CIED)-related infections within the first post-procedural year after CIED insertion. Methods: This study included 509 adult patients undergoing CIED implantation procedures between January 1, 2011 and December 31, 2015. The data were analyzed by t-test, chi-square test, Fisher’s exact test, and logistic regression analysis using SPSS/WIN 23.0. Results: Fifteen infections and 494 non-infections were examined. The CIED-related infection rate was 2.9%; patients with 14 pocket infections and one bacteremia were included in the CIED-related infection. The risk factors of CIED-related infections were the estimated glomerular filtration rate (eGFR) of ≤45 mL/min/1.73 m2 (Odds ratio [OR]=4.03, 95% confidence interval [CI],1.15-14.10) and taking a new oral anticoagulant (NOAC) (OR=4.50, 95% CI 1.09-18.55). Conclusion: These results identified the CIED infection rate and risk factors of CIED-related infection. It is necessary to consider these risk factors before the CIED implantation procedure and to establish the relevant nursing interventions.
서 론
1. 연구의 필요성
국내에서 급성 심정지(sudden cardiac death, SCD)를 경험하는 환자는 2019년 30,782명으로, 그중에 병원 도착 당시 자발순환이 회복된 환자는 2,470명(8.2%), 생존하여 퇴원한 환자는 2,623명(8.7%)에 불과하였다[1]. SCD는 지속적인 심실성 빈맥(ventricular tachycardia)이나 심실성 세동(ventricular fibrillation)과 같은 심실성 부정맥이 발생하였을 때 자주 일어난다[2]. 이식형 제세동기(implantable cardioverter defibrillator, ICD) 삽입이 치명적인 심실성 부정맥을 예방하고 SCD 위험이 있는 환자의 생존율을 높일 수 있음이 증명됨에 따라 ICD의 삽입 건수가 증가하고 있다[3]. 또한, 심장 재동기화 치료(cardiac resynchronization therapy)는 중증 심부전 환자의 생존율 뿐만 아니라 삶의 질까지도 향상시킬 수 있다[4].
ICD와 심장 재동기화 치료, 서맥성 부정맥의 표준 치료법 중 하나인 영구적 심박동기(permanent pacemaker, PPM)를 포함한 이식형 심장 모니터링 장치(cardiac implantable electronic device, CIED)를 삽입함으로써 심장질환자의 삶의 질과 생존율이 향상할 수 있다고 밝혀지면서 그 시술 횟수가 급격히 증가하고 있다[5]. 미국에서 1993년부터 2008년까지 PPM과 ICD의 시술이 해마다 평균 4.7%씩 증가하였고 CIED 삽입 건수가 96% 증가하였는데, 이는 PPM 삽입 건수가 45% 증가한 것에 비해 ICD 삽입 건수가 504% 급격히 증가한 것으로 인한 결과였다[6]. 국내 CIED 시술 추이를 살펴보면 2015년 한 해 CIED 시술 건수가 10,532건이었고, 2019년 13,580건으로 5년 동안 연평균 6.6% 증가하였다[7]. 이러한 CIED 시술 후에는 다양한 합병증이 보고되고 있어 CIED 시술을 받은 환자의 약 15%가 유도선 교정술(lead revision)과 같은 재시술, 기흉, CIED 관련 감염, 혈종 등 한 개 이상의 합병증을 경험한다[8]. 이러한 CIED 시술 후 합병증 중에서 CIED 관련 감염의 발생 건수는 미국에서 1993년부터 2008년까지 약 69,000건으로 감염 발생률이 1.61%였고, 감염 발생 건수가 1993년 2,660건에서 2008년 8,230건으로 210% 증가하였다[6]. 2014년부터 2016년까지 추적관찰 기간 동안 국내 CIED 관련 감염의 발생 건수는 총 462건으로, 감염 발생률이 100인년당 1.95명이었다[9].
CIED 관련 감염은 시술 후 감염이 발생할 때까지의 소요시간이 수일에서부터 수년까지 매우 다양하다[10]. CIED 관련 감염은 시술 후 발생 시기에 따라 초기 감염(early infection), 후기 감염(late infection), 지연된 감염(delayed infection), 매우 지연된 감염(very delayed infection)으로 나눌 수 있다. 초기 감염은 시술 후 1개월 이내에 발생한 것을 말하며, 전체 대상자의 28%를 차지했다. 후기 감염은 시술 후 1개월-1년 이내에 발생한 것을 말하며, 전체 대상자의 35%를 차지했다. 지연된 감염은 시술 후 1년을 초과하여 2년 이내에 발생한 것을 말하며 전체 대상자의 37%를 차지했다. 매우 지연된 감염은 시술 후 2년을 초과하여 발생한 것을 말하며 전체 대상자의 24%를 차지했다[11]. 초기 감염과 후기 감염을 포함한 1년 이내에 발생하는 CIED 관련 감염은 삽입 부위에서 홍반(erythema), 경결(tenderness), 열감(warmth), 미란(erosion)이 관찰되는 주머니 감염(pocket infection)의 증상을 주로 보이지만, 1년 이후에 발생하는 감염은 장치의 침식이나 심내막염으로 더 자주 나타난다[11]. ICD 삽입 후 6개월 이내에 발생하는 ICD 관련 감염은 만성 피부 질환의 유무와 연관성이 더 높았지만, 6개월 이후에 발생하는 ICD 관련 감염은 동반질환의 중증도를 반영하는 Charlson 동반질환 지수가 높거나 만성 혈액투석 환자, 만성 폐쇄성 폐질환(chronic obstructive pulmonary disease, COPD) 및 ICD 감염의 과거력이 있는 경우에 통계적으로 유의한 연관성이 있었다[12].
CIED 관련 감염의 발생빈도는 낮으나 다양한 외과적 이식 장치와 관련된 감염 중 심혈관 이식 장치 관련 감염 환자의 사망률이 가장 높다[13]. CIED 관련 감염의 발생 건수는 해가 지날수록 점점 증가하고 있는데, 이는 ICD 삽입 적응증의 확대, 기저질환이 많은 고령 환자들의 CIED 시술 건수 증가와 관련이 있다[6]. CIED 관련 감염이 진단되면 주머니(pocket)에 국한하여 발생하였더라도 CIED 관련 감염의 치료 가이드라인에 따라 유도선(lead)을 포함한 CIED 전체를 완전히 제거해야 하며 정맥을 통한 항생제 치료를 충분히 받아야 한다[5]. 이로 인해 CIED 관련 감염이 발생하게 되면 재원기간이 늘어나고 많은 의료비용이 소모되며 사망률도 증가시킬 수 있다[14]. 그러므로 CIED 관련 감염의 위험요인을 파악하여 감염을 예방하는 것이 중요하다. 지금까지 밝혀진 CIED 관련 감염의 위험요인에는 당뇨병, 말기 신부전(end-stage renal disease, ESRD), CIED 시술 전 일시적인 심박동기(temporary pacemaker, TPM)의 사용 등이 있다[15]. 또한, 신부전을 포함한 기저질환, 시술 후 혈종 유무, 삽입 장치의 유도선이 2개 이상인 경우 등[10]이었다.
국내 CIED 시술 건수는 해마다 증가하고 있으나, 그에 비해 CIED 관련 감염의 발생빈도와 위험요인에 대한 국내 연구논문은 적은 편이다. 국내 단일기관에서 처음으로 CIED를 삽입한 성인 환자 1,307명을 후향적으로 조사하여 CIED 관련 감염 환자의 발생빈도와 위험요인을 분석한 바에 따르면[16] 12명의 감염이 발생했으며, 감염 발생의 위험요인으로 반복적인 재시술이 분석되었다. 건강보험심사평가원 자료를 이용한 2014년부터 2016년까지의 CIED 삽입 환자 연구[9]에서는 감염 발생률이 100인년당 1.95명, CIED 관련 감염으로 인한 추가 의료비는 평균 16,584 US$이었으며, CIED 관련 감염의 위험요인으로는 재시술, 당뇨병, 심부전, 고혈압 등의 순서로 보고되었다. 2015년과 2019년에 시행한 국민건강보험공단(Korea National Health Insurance Service, KNHIS)의 주요 수술 통계 결과를 보면, 2015년 CIED 삽입 환자의 60세 이상의 비율은 전체의 약 78%였고, 2019년에는 약 84%에 해당하였으며 이를 통해 국내 CIED 삽입 대상자의 연령대가 높아지고 있음을 알 수 있다[7,17]. 이와 같이 국내 CIED 삽입 대상자 중 감염에 취약한 고령의 환자 수도 함께 증가하고 있다. 따라서 앞으로 재원기간과 의료비, 사망률을 증가시킬 수 있는 CIED 관련 감염의 발생 건수는 지금보다 증가할 것으로 여겨진다. 이에 본 연구는 국내 CIED 관련 감염의 위험요인을 파악함으로써 CIED 관련 감염을 예방하기 위해 CIED 삽입 예정 환자에게 제공할 간호중재에 대한 기초자료를 제시하고자 한다.
2. 연구의 목적
본 연구는 일 종합병원에서 CIED를 시술한 환자를 대상으로 CIED 관련 감염 환자의 위험요인을 파악하고자 한다. 구체적인 목적은 다음과 같다.
첫째, CIED 관련 감염군과 비감염군의 일반적 특성과 임상적 특성, 시술 관련 특성의 차이를 비교한다.
둘째, CIED 관련 감염의 위험요인을 분석한다.
연구 방법
1. 연구설계
본 연구는 일 종합병원에서 CIED를 시술한 환자를 대상으로 CIED 관련 감염 환자의 위험요인을 파악하기 위하여 시행한 서술적 조사연구이다.
2. 연구대상
본 연구는 S시 소재의 A 종합병원 내에서 2011년 1월 1일부터 2015년 12월 31일까지의 기간 내에 CIED 삽입, 전원 발생기 교환술(generator change), 유도선 교환술(lead change) 또는 유도선 교정술(lead revision)을 받은 성인 환자를 대상으로 하였다. 시술 후 1년까지의 기간에 대부분 감염이 발생한다는 선행연구[11]를 참고하여 전자의무기록(Electronic Medical Record, EMR)을 조사하였다. 선정기준에 해당하는 환자 수는 총 1,210명이었고, 이 중 타 병원에서 이미 이식형 심장 모니터링 장치를 삽입하고 내원한 환자 56명, 시술 시행 후 1년 뒤 외래 방문 또는 재입원을 하지 않아서 추적관찰이 안 된 환자 611명, 의무기록이 미비한 환자 34명을 제외한 최종 509명을 대상자로 선정하였다.
본 연구의 대상자 수는 선행연구를 참고하여 CIED 관련 감염과 관련된 변수가 고령[18], 남성[18,19], 신기능 장애와 항응고제[11,18], COPD [12], 예방적 항생제 투여 부족[19-22], 삽입 장치의 종류[23-25], 이전 시술 횟수[11-26], 시술 24시간 전 고체온[20], 시술 전 TPM 적용[20], 삽입 장치의 유도선이 2개 이상인 경우[27], 시술 후 혈종[21] 등 17개로 최소 170명의 대상자가 요구되어[28] 본 연구의 대상자 수 509명은 최소 대상자 수의 기준을 충족하였다. 환자들의 EMR을 통해 대상자의 자료를 수집하였다.
본 연구에서는 선행연구[16]를 참고하여 2011년 1월부터 2015년 12월까지 CIED 삽입, 전원 발생기 교환술(generator change), 유도선 교환술(lead change) 또는 유도선 교정술(lead revision)을 받은 환자 중 시술일로부터 1년 이내에 재입원 또는 외래 방문 시 진단받은 상병이 ‘상처 감염(wound infection)’인 경우와 ‘균혈증’, ‘심내막염’이면서 상병의 원인이 CIED와 관련이 있는 경우를 CIED 관련 감염으로 정하였다.
3. 연구도구
감염군은 입원일로부터 CIED 관련 감염이 발생하기 전까지, 비감염군은 입원일로부터 시술 후 1년까지의 기간 동안 추적 관찰하관찰하였다[11]. CIED 관련 감염군은 감염 부위에 따라 주머니 감염(pocket infection), 균혈증(bacteremia), 감염성 심내막염(infective endocarditis, IE)으로 구분하였다. 본 연구에서 주머니 감염은 상처 감염을 진단받은 환자 중 CIED 삽입 부위 주변 피부의 발적, 경결, 열감, 미란을 보이는 경우이다. 균혈증은 균혈증을 진단받은 환자 중 그 원인이 CIED와 관련이 있는 경우이다[16]. IE는 감염성 심내막염의 진단 기준인 modified Duke criteria를 충족하고 IE를 진단받은 환자 중에서 원인이 CIED와 관련이 있는 경우이다[10]. 주머니 감염의 경우에는 피부의 국소 증상이 관찰된 날, 균혈증의 경우에는 혈액배양 검사 결과에서 균 동정이 확인된 날, IE의 경우에는 경식도 심장초음파 검사 결과를 통해 확진된 날로 감염 발생일의 기준을 정하였다. 본 연구에서 비감염군은 앞에서 말한 CIED 관련 감염군에 해당하는 조건이 충족하지 않는 대상자 모두를 의미한다.
대상자의 일반적 특성, 임상적 특성, 시술 관련 특성에 대한 자료가 포함된 증례기록서를 통해 환자의 EMR을 확인하여 자료를 수집하였다.
1) 일반적 특성
일반적 특성으로는 입원 당시 환자의 성별, 연령, 입원경로, 재원기간, 흡연 유무에 대한 자료를 수집하였다. 연령은 위험요인인 고령이 유의한 변수인지 확인하기 위해 60세 미만과 60세 이상으로 구분하여 분석하였다[18].
2) 임상적 특성
임상적 특성으로는 CIED의 종류, CIED 삽입의 적응증, 기저질환, 입원 당시 혈액투석 여부, 시술 24시간 전 고체온 발생 여부, 시술 후 항응고제 복용 여부 및 항응고제의 종류에 대해 자료 수집하였다. 시술 후 복용한 항응고제의 종류에는 와파린, 아스피린, 클로피도그렐, 새로운 경구용 항응고제(new oral anticoagulant, NOAC)가 있으며 항응고제 종류에 따른 CIED 관련 감염군과 비감염군의 임상적 특성의 차이를 비교하였다. 또한, 대상자의 임상적 특성으로 혈액검사 결과와 심장초음파 검사 결과를 확인하였다. 먼저, 혈액검사의 경우에는 백혈구, 혈색소, 호중구, 혈소판, C 반응성 단백질(C-reactive protein, CRP), 크레아티닌(creatinine), 추정 사구체 여과율(estimated glomerular filtration rate, eGFR), 아스파르트산 아미노 전이 효소(aspartate amino transferase, AST), 알라닌 아미노 전이 효소(alanine amino transferase, ALT)로 시술 당일에 시행한 결과를 확인하였다. 만약 시술 당일에 시행한 혈액검사 결과가 없다면, 시술 전날에 시행한 결과를 확인하였고 시술 전날에 시행한 혈액검사 결과도 없을 때는 입원 후 시술 전에 시행한 검사 결과를 확인하였 다. 시술 전 당일에 시행한 검사 결과가 2개 이상일 경우에는 시술 시간에 가깝게 시행한 검사 결과를 확인하였다.
크레아티닌은 신장 기능이 유의한 변수인지 확인하기 위해 1.5 (mg/dL) 미만과 이상으로 구분하여 분석하였다[18]. eGFR은 CIED의 완전한 제거를 요하는 CIED 관련 감염의 위험요인인 만성 신부전(chronic kidney disease, CKD) IIIB 단계 이상이 유의한 변수인지 아닌지를 확인하기 위해 45 mL/min/1.73 m2 이하와 초과로 구분하여 분석하였다. 심장초음파 검사 결과 중에 구축률(ejection fraction, EF) 수치는 시술 전에 시행한 심장초음파 검사 결과를 통해 확인하였다.
3) 시술 관련 특성
시술 관련 특성은 CIED 관련 시술 총 시행횟수, 삽입한 CIED의 유도선(lead) 개수, 시술 총 소요시간, 시술 전에 투여한 예방적 항생제의 종류 및 시술 직전 투약 여부, 시술 후 혈종 발생 여부, 시술 전 TPM 적용 여부를 조사하였다.
4. 자료수집
본 연구는 연구 대상기관의 심장내과와 간호부의 승인을 받고, 의료정보관리팀에 본 연구의 목적을 설명한 후 협조를 얻어 의무기록 접근 권한을 부여받아 자료를 수집하였다. 자료수집기간은 2017년 3월부터 5월까지였으며, 2011년 1월 1일부터 2015년 12월 31일까지 CIED 삽입, 전원 발생기 교환술(generator change), 유도선 교환술(lead change) 또는 유도선 교정술(lead revision)을 받은 환자의 전자의무기록 중 간호정보조사, 검사 간호 기록(시술 기록), 의사 경과 기록, 간호과정기록, 통합검사결과(혈액검사, 심장초음파 검사)를 후향적으로 검토하였다. 증례기록서는 심장내과 전담간호사 1명, 간호대학원 교수 1명, 병동 간호사 2명을 포함한 총 4명에게 검토 받아 확정하였다. 연구 대상자는 연구 대상 병원에서 처음 CIED를 삽입한 환자 중에서 재입원 또는 외래 방문 시 주머니 감염(pocket infection), 균혈증(bacteremia) 또는 감염성 심내막염의 진단 여부에 따라 감염군과 비감염군으로 분류하였다. 본 연구에서는 심장내과 병동에서 8년 이상 근무하여 CIED 관련 감염 환자에 대한 경험이 풍부한 연구자 1인이 CIED 관련 감염 기준에 따라 감염 여부를 확인하였다.
5. 자료분석 방법
수집된 자료는 SPSS/WIN 23.0을 이용하여 다음과 같이 분석하였다.
CIED 관련 감염군과 비감염군의 일반적 특성과 임상적 특성, 시술 관련 특성은 실수와 백분율, 평균과 표준편차를 이용하였고, 두 군의 차이를 t-test와 chi-square test, Fisher’s exact test로 분석하였다.
CIED 관련 감염군의 위험요인을 파악하기 위해서 다중 로지스틱 회귀분석을 통해 분석하였다.
통계적 검정의 유의수준은 <.05를 기준으로 판단하였다.
6. 윤리적 고려
본 연구는 연구 대상기관의 기관윤리위원회(Institutional Review Board, IRB)의 승인(IRB 승인번호 2017-0070)을 취득한 후 진행하였다. 수집된 자료는 모두 전산화되어 암호 설정된 파일의 형태로 잠금장치가 있는 연구용 컴퓨터에 저장하였으며, 증례기록서와 같은 문서화된 자료는 잠금장치가 있는 장소에 보관하였다. 대상자의 인적사항에 대한 비밀을 철저히 유지하였으며, 모든 자료는 본 연구자가 직접 수집하였고 대상자를 파악할 수 없도록 모두 익명으로 처리하였다.
연구 결과
1. CIED 관련 감염군과 비감염군의 일반적 특성 및 감염종류
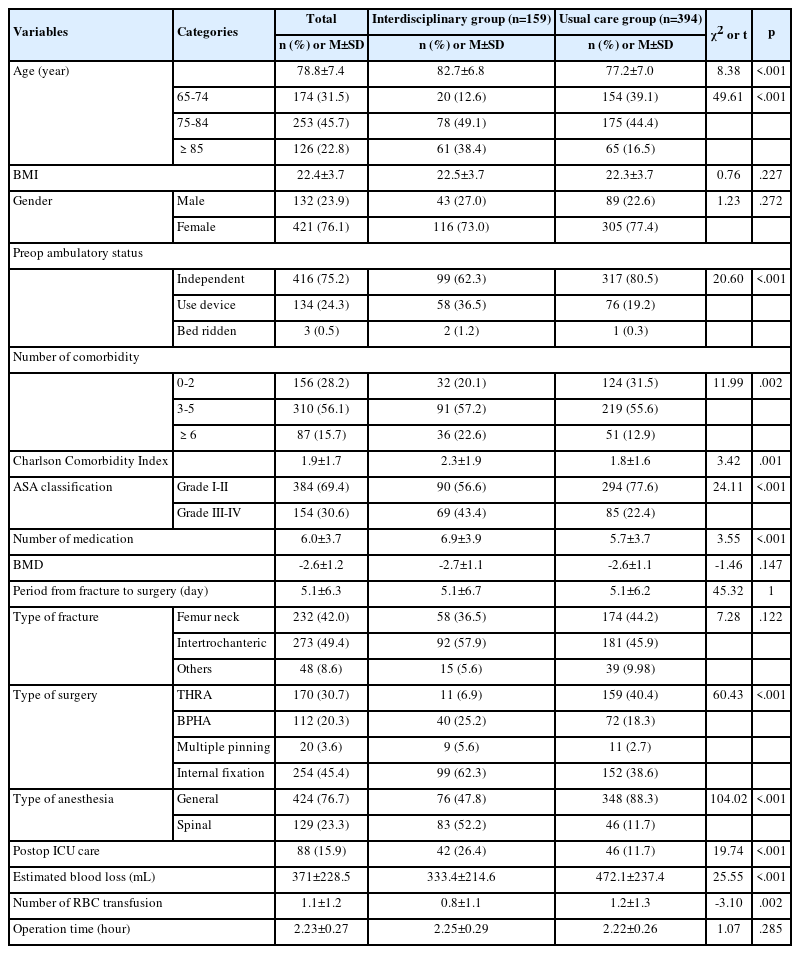
전체 대상자의 일반적 특성은 다음과 같다(Table 1). 남자 280명(55.0%), 연령 평균은 64.39±13.75세였다. 재원기간의 평균은 10.53±9.95일이었다. 입원 당시 흡연 상태인 대상자는 38명(7.5%)이었다. 감염군과 비감염군 비교 시 연령(t=1.49, p=.137), 성별(χ2=0.44, p=.510), 입원 경로(χ2=0.16, p=.925), 재원일수(t=0.53, p=.598), CIED의 종류(χ2=0.67, p=.716), 흡연상태(p=.310), 60세 이상 연령(p=.409)은 통계적으로 유의한 차이가 없는 것으로 나타났다. 감염은 총 15건으로 주머니 감염(pocket infection) 14건, 균혈증(bacteremia) 1건이었다.
2. CIED 관련 감염군과 비감염군의 임상적 특성
전체 대상자의 임상적 특성은 다음과 같다(Table 2). CIED의 종류는 PPM이 373명(73.3%)으로 가장 많았으며 CIED 삽입의 적응증은 방실차단 206명(40.5%)이 가장 많았다. 감염군과 비감염군을 비교했을 때 NOAC 복용(p=.020), 45 mL/min/1.73 m2 이하의 eGFR (p=.044)에서 유의한 차이를 보였다.
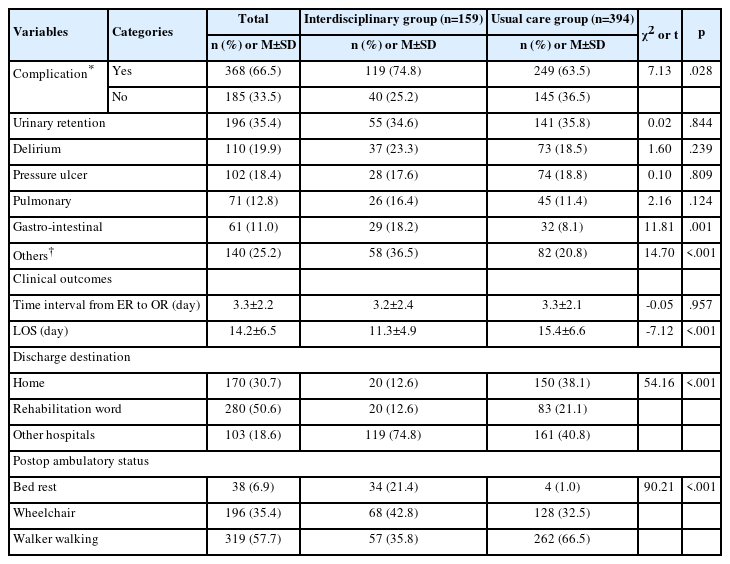
3. CIED 관련 감염군과 비감염군의 시술 관련 특성
전체 대상자의 시술 관련 특성은 다음과 같다(Table 3). CIED의 유도선 개수의 평균과 표준편차는 1.86±0.43개이었다. 시술 총 시행횟수는 평균 1.36±0.64회였고, 시술 총 소요시간은 평균 117.54±52.26분이었다. 감염군과 비감염군을 비교하였을 때, 시술 총 시행횟수(t=1.74, p=.104), CIED의 유도선 개수(t=-0.57, p=.569), 시술 소요시 간(t=0.14, p=.893), 시술 후 혈종(p=.520), 시술 전 TPM 적용(p>.999), 시술 전 예방적 항생제 사용(p=.505)은 두 군 간에 통계적으로 유의한 차이가 없었다.
4. CIED 관련 감염의 위험요인
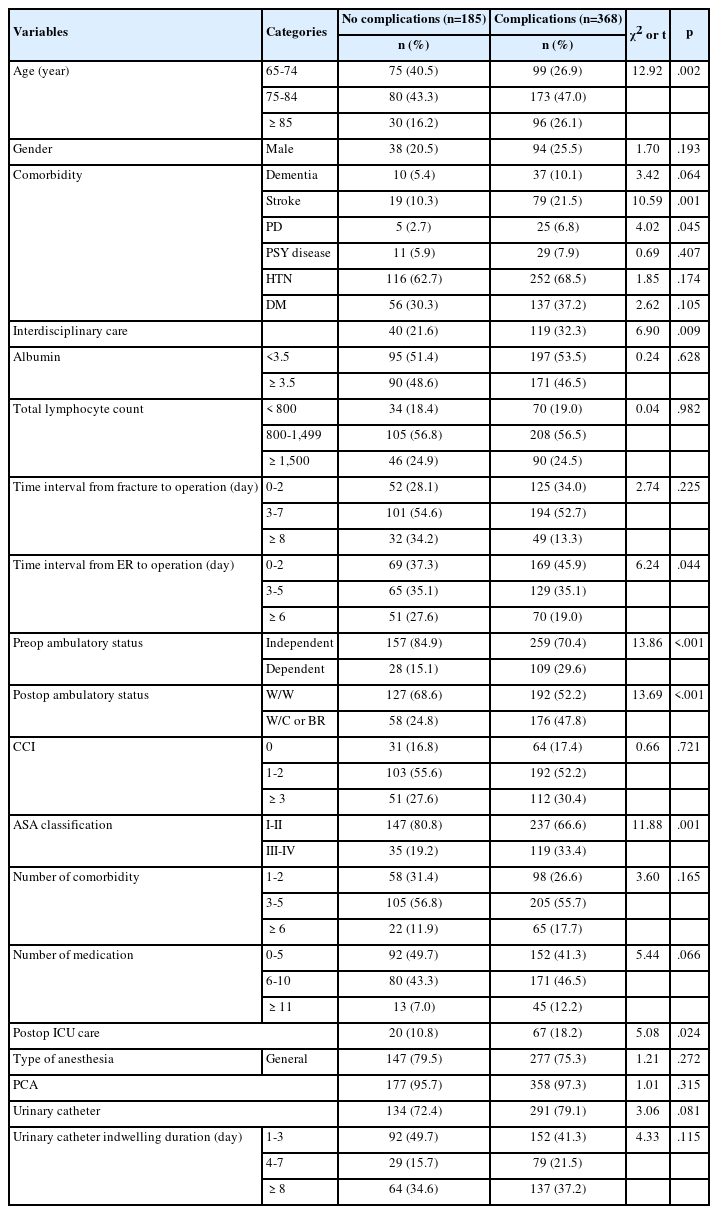
CIED 관련 감염의 위험요인을 파악하기 위하여 t-test 혹은 교차분석에서 유의확률이 <.15인 변수를 투입하여[29], 다변량 로지스틱 회귀분석을 실시하였다(Table 4). 이는 불필요한 변수를 조절하면서 의미있는 변수를 포함하기 위한 것으로 선행연구를 근거로 하였다[29]. 최종 회귀모형은 유의하였고(F=12.66, p=.005), 모형의 적합성은 Hosmer와 Lemeshow 검정 결과 자료에 잘 부합되는 것으로 나타났다(χ2=1.03, p=.599).

Multivariate Logistic Regression Analysis of Risk Factors for Cardiac Implantable Electronic Device-related Infections (N=509)
eGFR이 45 mL/min/1.73 m2 이하일 경우에 45 mL/min/1.73 m2 초과인 경우에 비하여 4.03배(95% Confidence interval [CI] 1.15-14.10, p=.029) CIED 관련 감염의 위험이 있었다. 시술 후 처방된 항응고제 중에 NOAC을 복용한 경우가 복용하지 않을 때보다 4.50배(95% CI 1.09-18.55, p=.038) 감염의 위험이 있었다. 아스피린을 복용한 경우에는 두 집단 간에 유의한 차이가 없었다(Odds ratio [OR]=0.18, 95% CI 0.02-1.43, p=.104).
논 의
CIED 관련 감염은 정맥을 통한 항생제 투여 치료를 위해 입원치료가 필요하고, 대부분 CIED를 제거해야 하므로 많은 의료비용이 소모되며, 환자의 예후에도 영향을 미칠 수 있다. 이에 본 연구는 CIED 삽입, 전원 발생기 교환술(generator change), 유도선 교환술(lead change) 또는 유도선 교정술(lead revision)을 받은 환자를 대상으로 CIED 관련 감염의 발생빈도와 위험요인을 파악하고자 시도하였다.
본 연구에서 CIED 관련 1년 이내 감염 발생률은 약 2.9%이었다. CIED 삽입 후 수술 부위 감염을 1년 동안 추적 관찰한 선행연구[30]에 의하면 대상자의 2.3%에서 감염이 발생하여, 이는 본 연구에서의 발생률과 유사하였다. CIED 관련 감염의 발생빈도는 낮으나, CIED 제거와 추가적인 항생제 사용, 재원기간의 연장 등으로 인해 시술 후 합병증 중에서 가장 의료비 소모가 심하므로 CIED 관련 감염의 위험요인을 파악하고 이를 관리할 필요가 있다[20].
본 연구에서는 eGFR이 45 mL/min/1.73 m2 이하인 경우, CIED 관련 감염의 위험이 4.03배였다. 선행연구에서 CIED 장치를 제거한 환자 1,017명 중에서 장치 제거의 원인을 기준으로 감염과 비감염으로 나누어서 두 그룹 간의 일반적·임상적 특성과 신기능 장애 정도를 비교한 결과 chronic kidney disease (CKD) 단계 중 IIIB (eGFR≤45 mL/min/1.73 m2), IV (eGFR 30-15 mL/min/1.73m2), V (eGFR <15 mL/min/1.73 m2)에 해당하는 중증 신부전이 있는 환자의 비율이 감염 31.9%, 비감염 19.9%로, 감염이 원인인 경우가 더 높았다[31]. CKD IIIB, IV, V단계인 환자에서 1년 사망률이 각각 15%, 20%, 30%만큼 높았다. 이는 본 연구결과와 맥락이 일치한다. 신부전은 면역기능의 저하를 일으키므로 CIED 관련 감염이 발생할 위험을 증가시킨다[18]. 그러므로 CIED 관련 감염을 예방하기 위해서는 CIED 삽입, 전원 발생기 교환술(generator change), 유도선 교환술(lead change) 또는 유도선 교정술(lead revision) 같은 시술을 위해 입원한 환자의 신 기능 장애 정도를 알 수 있는 크레아티닌이나 eGFR 수치를 주의 깊게 관찰하고 eGFR에 영향을 미치는 약물이나 다른 요인이 있는지 환자에게 문진을 통해 확인해야 할 것이다. 또한, 시술 전에 시행한 혈액검사 결과 eGFR이 45 mL/min/1.73 m2 이하인 경우에는 CIED 관련 감염의 위험요인이 있음을 주지하고, 이를 예방하기 위한 간호중재 계획을 세워야 하며, 시술 후에 CIED 시술 부위의 감염 증상 이 없는지 자주 관찰하고 무균술(aseptic technique)을 준수하여 드레싱을 시행할 필요가 있다.
본 연구에서 시술 후 처방된 항응고제 중에 NOAC을 복용했을 때, CIED 관련 감염의 위험이 4.5배였다. NOAC이 아직 임상에 적용된 기간이 짧아 다양한 임상 상황에서의 약의 효능과 안정성이 입증되지 않았고, CIED 관련 감염의 위험요인으로서 NOAC과 다른 항응고 약물을 직접적으로 비교한 연구가 없어서 선행연구와 본 연구의 결과를 비교하기는 어렵다. 이에 앞으로 NOAC을 비롯한 항응고제의 복용이 CIED 관련 감염에 미치는 영향에 대한 반복연구를 제안한다. 또한, 감염군의 표본수가 비감염군에 비해 매우 적었기 때문에 본 연구의 결과를 일반화하기에는 어려우므로 추후 이에 대한 다기관 반복 연구를 제안한다.
본 연구에서는 아스피린을 복용했을 때가 복용하지 않았을 때보다 감염의 위험이 0.18배였으나 통계적으로 유의하게 나타나지는 않았다. CIED 관련 감염의 임상 징후 발생 전 아스피린 단독 투여요법에 대한 연구에서는 CIED 관련 감염이 발생하기 전에 아스피린을 매일 복용한 환자군은 그렇지 않은 군에 비해 감염의 전신증상이 나타나지 않거나, 심장초음파를 시행했을 때 CIED 유도선 또는 판막에 있는 군락(vegetation)을 찾기 어려웠다[32]. 본 연구에서는 대상자의 인구학적 분포가 선행연구[32]와 달랐고 감염군 중 아스피린 복용 환자의 표본수가 1명으로 매우 적었기 때문에 아스피린 복용 여부가 유의하지 않은 결과가 나온 것으로 보인다. 이에 아스피린을 비롯한 항응고제와 CIED 관련 감염의 연관성에 대해 추후 다기관 연구를 제안한다.
본 연구에서는 당뇨병 환자 중 CIED 관련 감염군과 비감염군의 비율을 비교했을 때 감염군 약 13.3%, 비감염군 약 22.7%였으며 통계적으로 유의한 차이를 보이지는 않았다. CIED 관련 감염군과 비감염군에서 각각 당뇨병이 있는 환자의 비율을 비교한 연구에서 감염군 44%, 비감염군 27%였고 당뇨병이 있는 환자가 없는 환자에 비해 CIED 관련 감염의 위험이 2.18배 증가했으며 통계적으로 유의하였다[33]. 심외막 ICD 시술과 흉골절개술을 받은 157명을 대상으로 한 연구에서는 당뇨병이 있는 환자가 없는 환자에 비해 CIED 관련 감염의 위험이 13.94배 증가하였고 통계적으로 유의하였다[34]. 본 연구는 선행연구[33,34]와 비교하여 인구학적 분포가 달랐고, 전체 대상자에서 당뇨병이 있는 환자의 비율이 낮았기 때문에 당뇨병이 유의하지 않은 결과가 나온 것으로 사료된다.
본 연구에서는 CIED 관련 감염군과 비감염군에서 각각 시술 횟수의 평균과 표준편차를 비교했을 때 감염군 1.80±1.01회, 비감염군 1.34±0.62회였으나, 두 군 간에 통계적으로 유의한 차이가 없었다. CIED 관련 감염의 위험요인으로서 시술 횟수를 제시한 선행연 구[16]에 따르면, 시술 횟수가 1회 증가할 때마다 CIED 관련 감염의 위험이 19.33배이었다. 하지만 본 연구는 CIED 관련 감염의 조작적 정의가 시술 후 1년 이내로, 발생 시기에 상관없이 전수를 조사한 선행연구[16]와 달랐고 감염군의 60%가 첫 시술이었기 때문에 시술 횟수가 유의하지 않은 결과가 나온 것으로 보인다. 이에 시술 횟수와 CIED 관련 감염의 연관성에 대해 추후 반복 연구가 필요하다고 생각된다.
본 연구의 제한점은 다음과 같다. 첫째, 본 연구의 독립변수 이외의 기타 변인이 CIED 관련 감염에 영향을 미치는 혼재 현상(confounding)을 방지하기 위해 CIED 관련 감염 환자 중 타 병원에서 CIED를 삽입한 환자들은 본 연구에서 제외되어 대상자 선정에 영향을 미쳤을 가능성을 배제할 수 없다. 둘째, 선행연구에 따라 60세 이상 연령을 고령의 기준 나이로 설정하여 연구하였으나, 의료기술의 발전으로 인해 기대 수명이 연장되면서 CIED 삽입 환자의 연령 또한 높아지고 있다는 점을 반영하지 못한 한계점이 있다. 셋째, 드물게 발생하는 이식 감염 발생의 특성상 장기간의 추적을 통해 정확한 위험요인 규명이 가능하지만, 연구 대상 병원의 3차 대형 병원이라는 특성으로 인해 시술 후 1년을 초과하여 지속적으로 추적 관찰하지 못한 제한점이 있다. 넷째, 단일기관을 대상으로 한 조사연구로 CIED 관련 감염군의 표본수가 매우 적어 연구결과를 일반화하는데 제약이 있으며 의무기록 조사를 통한 후향적 연구이기에 연구결과가 기록의 충실도에 영향을 받을 수 있다는 제한점도 있다. 다섯째, 의무기록 검토(review)의 신뢰도 보장을 위해서 2명의 평가자의 일치도 측정이나 평가자 간 신뢰도(Inter-rater reliability)를 통해 자료수집 결과값의 신뢰도를 보장하는 연구설계가 이루어지지 못한 한계점도 있다. 여섯째, 선행연구에서 CIED 관련 감염의 위험요인으로 보고된 임상적 특성에 대한 변수 중 Charlson 동반질환 지수를 본 연구에서 조사하지 못한 부분도 한계점으로 사료된다. 그러므로 이러한 제한점을 반영하여 추후 CIED 관련 감염의 위험요인에 대한 전향적, 다기관 연구가 필요하다. 본 연구는 CIED 삽입, 전원 발생기 교환술(generator change), 유도선 교환술(lead change) 또는 유도선 교정술(lead revision)과 같은 시술 후 1년 이내에 CIED 관련 감염의 발생빈도와 위험요인을 조사하여 CIED 관련 감염 중 초기 감염과 후기 감염의 전수를 처음으로 조사한 연구로서 의의가 있다고 생각한다. 또한, CIED 관련 감염의 위험요인으로 NOAC 복용 여부에 대해 처음으로 조사한 연구로 의미가 있다고 생각한다.
결 론
본 연구에서는 CIED 시술 후 1년 이내에 초기 감염과 후기 감염의 발생빈도와 위험요인을 파악하였다. CIED 관련 감염 발생률은 2.9%였고, 15건의 감염이 발생하였으며 CIED 관련 감염의 위험요인은 NOAC 복용과 eGFR이 45 mL/min/1.73 m2 이하였다. 이를 통해 본 연구는 CIED 삽입 예정 환자에게 CIED 관련 감염을 예방하기 위해 제공할 간호중재에 대한 기초자료로 활용될 것으로 기대할 수 있다. 즉, CIED 관련 시술 예정 환자의 혈액검사 결과를 미리 확인한 후 CKD IIIB 단계 이상의 신기능 장애가 있을 때에는 CIED 관련 감염의 위험요인이 있음을 인지하고 시술 직후부터 퇴원할 때까지 시술 부위의 발적, 출혈, 혈종 등의 이상 소견이 없는지 주의깊게 관찰해야 하며 환자와 보호자에게 무균술을 준수하여 시술 부위의 소독 및 드레싱을 시행할 수 있도록 충분한 교육이 필요하다. 본 연구를 바탕으로 다음을 제언하고자 한다. 첫째, CIED 관련 감염의 위험요인에 대한 다기관 연구가 필요하다. 본 연구에서는 감염군의 표본수가 비감염군에 비해 매우 적어 연구결과를 일반화에 제한이 있으므로 이에 대한 추후 다기관 연구가 필요하다. 또한, 다양한 임상 상황에서 NOAC의 효능과 안전성이 입증되지 않았고 NOAC과 다른 항응고제를 직접적으로 비교한 연구가 없어 앞으로 NOAC을 비롯한 항응고제의 복용이 CIED 관련 감염에 미치는 영향에 대한 다기관 반복연구가 필요하다. 둘째, CIED 삽입 후 1년 이후에 발생하는 지연된 감염의 발생빈도 및 위험요인에 대한 후속 연구가 필요하다. 셋째, CIED 관련 감염 환자의 재원기간, 의료비, 사망률에 대한 추후 연구를 제안한다.
CONFLICT OF INTEREST
The authors declared no conflict of interest.
AUTHORSHIPS
PJY and CHR contributed to the conception and design of this study; PJY collected data; PJY and CHR performed the statistical analysis and interpretation; PJY drafted the manuscript; PJY and CHR critically revised the manuscript; CHR supervised the whole study process. All authors read and approved the final manuscript.