복강경 수술에서 기복제 이산화탄소의 37°C 가온이 수술 중 체온, 수축기압 및 심박동수와 산염기 균형에 미치는 영향
Effects of 37°C Carbon Dioxide Pneumoperitoneum on Core Body Temperature, Systolic Blood Pressure, Heart Rate and Acid-Base Balance: A Randomized Double-blind Controlled Trial
Article information
Abstract
Purpose: The purpose of this study was to compare the effects of 21°C CO2 and 37°C CO2 pneumoperitoneum on body temperature, blood pressure, heart rate, and acid-base balance. Methods: Data were collected at a 1300-bed university hospital in Incheon, from February through September 2012. A total of 74 patients who underwent laparoscopic colectomy under general anesthesia with desflurane were randomly allocated to either a control group or an experimental group. The control group received 21°C CO2 pneumoperitoneum; the experimental group received 37°C CO2 pneumoperitoneum. The pneumoperitoneum of the two groups was under abdominal pressure 15 mmHg. Body temperature, systolic blood pressure, heart rate and acid-base balance were assessed at 30 minutes and 90 minutes after pneumoperitoneum, and again at 30 minutes after arriving at the Post Anesthesia Care Unit. Results: Body temperature in the 37°C CO2 pneumoperitoneum group was significantly higher (F=9.43, p<.001) compared to the 21°C CO2 group. However, there were no statistically significant differences in systolic blood pressure (p=.895), heart rate (p=.340), pH (p=.231), PaCO2 (p=.490) and HCO3- (p=.768) between the two groups. Conclusion: Pneumoperitoneum of 37°C CO2 is effective for the increase of body temperature compared to pneumoperitonium of 21°C CO2, and it does not result in a decrease of blood pressure, heart rate or acid-base imbalance.
서 론
1. 연구의 필요성
복강경 수술은 도입 초기에 여성의 불임시술, 충수돌기절제술과 담낭절제술 등의 단시간 수술에 이용하였지만 최근에는 3시간 이상 소요되는 대장절제술에 이용될 정도로 적용 범위가 확대되고 있다[1]. 복강경 수술은 개복술과 비교하여 통증이 적고, 회복이 신속하여 재원기간이 짧고, 수술 후 일상생활에의 복귀가 신속하다 는 장점으로[2-4] 대장암 환자의 70%가 복강경 대장절제술을 받았을 정도로[5] 일반화되어가는 추세이다.
복강경 수술이란 복부 절개 없이 특수 카메라가 장착된 내시경과 비디오 모니터를 복강 내로 삽입하여 수술을 하는 것으로[3,4] 수술공간을 확보하기 위해 복강 내로 가스를 유입시키는 기복(pneumoperitoneum)이 필수적이다. 1970년대에 복강경 수술의 기복제로 실내공기, 산소 또는 아산화질소를 이용했으나 가스 색전증이나 가스폭발의 위험이 보고된 후 이산화탄소(CO2)를 사용하고 있다[5]. 이산화탄소는 무색 및 무취의 가스로 비인화성이며, 혈액용해도가 높고 가스 색전증의 위험성이 낮아[5] 전 세계적으로 복강경 수술의 기복제로 사용하고 있다. 의료용 이산화탄소는 -90°C 액체로 압축하여 기통에 저장한 상태에서 가스로 복강 내로 유입시키는데[6] 이때 이산화탄소 가스의 온도가 19-21°C 로 체온보다 낮기 때문에 수술 중 저체온을 초래하고 기복 중 이산화탄소가 복막을 통해 흡수되어 산염기 불균형을 초래한다는 문제가 제기되었다.
저체온이란 심부체온이 36°C 미만으로 저하되는 것으로 개복술 환자의 40-60%, 복강경 수술환자의 60-90%에서 발생하는데[7-10] 수술 중 저체온은 혈소판 기능과 면역기능을 억제하고 수술후 감염증을 유발하고 수술 및 마취로부터의 회복을 지연시킨다[3,4,11]. 또한 저체온은 순환 혈중 카테콜아민을 증가시켜 말초혈관 수축, 빈맥 및 고혈압 등을 초래하는 등 심혈관계에 영향을 미치므로[12] 수술 및 마취 간호실무에서 중요하다. 수술 중 저체온은 마취유형, 수술소요시간, 수액량, 수혈량과 수술실 실내온도와 같은 외적 요인[7]과 환자의 나이, 체중과 수술 전 체온 등의 영향을 받는 것으로 보인다[9,10]. 복강경 수술은 개복술과 비교하여 수술 절개창이 작고 수술부위의 노출이 적어 저체온 발생이 적을 것으로 생각할 수 있다. 그런데 50 L의 이산화탄소를 사용할 때 체온이 0.3°C 정도 저하되며[13] 위장관 관련 복강경 수술에서 19-21°C 이산화탄소를 180-200 L를 사용하므로[14,15] 저체온 발생이 높아질 수 있다.
Ott [13,16]는 기복제로 19-21°C 이산화탄소 대신에 30°C 이산화탄소를 사용했을 때 수술 중 체온의 저하가 적었다며 수술 중 저체온을 최소화하기 위해 이산화탄소의 가온을 적극적으로 주장하였다. 기복제 이산화탄소의 37°C 가온이 수술 중 심부체온을 0.2-0.5°C 정도 상승시켰다는 보고도 있지만[4,6,17,18] 이산화탄소 가온이 수술 중 심부체온 상승에 영향을 미치지 못한 것으로 보고한 선행연구도 있어[15,19-22] 기복제 이산화탄소의 가온이 수술 중 체온에 미치는 효과에 대해 다소 논란이 있다.
한편 복강경 수술 중 복막을 통해 체중 1 kg 당 200 mL/hour의 이산화탄소가 흡수되어 혈역학 기능과 산염기 균형에 부정적 영향을 미친다는 우려도 있지만[23,24] 기복압 15 mmHg를 유지할 때 19-21°C 이산화탄소를 기복제로 사용하는 것은 건강한 성인에게 큰 문제가 없다는 견해가 일반적이다[25-27]. 그런데 Bashirov 등[19]은 “물질의 확산계수가 온도에 비례한다.”는 Fick’s diffusion law를 기반으로 이산화탄소의 37°C 가온이 복막을 통한 이산화탄소의 흡수를 증가시켜 혈역학 기능을 저하시키고 산염기 불균형을 초래한다고 보고하고 있다.
이에 본 연구자들은 복강경 수술의 기복에 사용하는 이산화탄소의 37°C 가온과 관련한 국내외 선행연구 고찰을 통해 몇 가지 문제점을 제기하고자 한다. 첫째, 복강경 수술에서 기복제 이산화탄소 가온이 수술 중 체온에 미치는 효과가 상반되어 있다는 점이다[4,6,17-22]. 둘째, Bashirov 등[19]은 Fick’s diffusion law [28]를 근거로 이산화탄소의 37°C 가온이 이산화탄소의 흡수를 증가시켜 산증을 초래한다고 주장하지만 이산화탄소를 가온했을 때 오히려 기복제 소모량이 감소하는 것으로 보고한 연구들도 있다[14,15]. 셋째, 기복 적용이 2시간 이상 되는 연구가 많지 않아[21] 2-3시간 이상의 이산화탄소 기복이 인체에 미치는 영향을 충분히 관찰하기가 어렵다는 점이다. 넷째, 기복제 이산화탄소의 흡수가 산 염기 불균형에 초래한 것으로 보고한 연구가 돼지를 이용한 동물실험연구로써[19,24] 연구결과를 인간에게 직접 적용하는 것은 무리가 있다고 생각한다.
이에 본 연구자는 수술소요시간이 2-3시간 이상 되는 복강경 대장절제술 환자를 대상으로 37°C의 이산화탄소 가온이 수술 중 체온, 심박수 및 혈압과 산염기 균형에 미치는 영향을 관찰하여 복강경 수술환자의 간호실무에 대한 기초자료로서의 근거를 제공하고자 본 연구를 시도하였다.
2. 연구목적 및 연구가설
본 연구의 목적은 대장암으로 진단받고 전신마취 하에 복강경 대장절제술을 받은 40세 이상 성인 환자를 대상으로 37°C의 이산화탄소 가온이 수술 중 체온, 혈압, 심박동수와 산염기 균형에 미치는 효과를 파악하기 위함에 있으며 연구가설은 다음과 같다.
마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분 시점에서 21°C 이산화탄소 기복군과 37°C 가온 이산화탄소 기복군 간에 체온은 차이가 있을 것이다.
마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분 시점에서 21°C 이산화탄소 기복군과 37°C 가온 이산화탄소 기복군 간에 혈압 및 심박수는 차이가 있을 것이다.
마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분 시점에서 21°C 이산화탄소 기복군과 37°C 가온 이산화탄소 기복군 간에 산-염기 지수에 차이가 있을 것이다.
3. 용어정의
1) 기복
수술시야를 확보하고, 복강내용물을 조작하기 위해 복강 내로 아산화질소, 이산화탄소 또는 공기 등을 주입하여 복부를 팽창시키는 것으로[5] 본 연구에서는 가습주입기(40 L Core insufflator, Stryker, Berlin, Germany)를 이산화탄소를 복강 내 주입하고 15 mmHg의 기복압을 유지하는 것을 의미한다.
2) 기복가스 가온요법
복강경 수술에 사용하는 기복가스를 가온하는 것으로 본 연구에서는 가온 전용케이블(WISAP Endo-Digi-View 3 mL D, Stryker, Berlin, Germany)을 이용하여 21°C의 이산화탄소를 37°C로 가온하는 것을 뜻한다.
연구 방법
1. 연구 설계
본 연구는 복강경 수술의 기복제 이산화탄소 가온이 수술 중 체온 심박수 및 혈압과 산염기 균형에 미치는 영향을 파악하기 위한 무작위화 대조군 실험연구설계이다.
2. 연구 기간 및 대상자
본 연구는 인천광역시에 소재하는 G 대학병원 수술실에서 대장암 진단을 받고 전신마취 하에 복강경 대장절제술을 받은 40세 이상의 성인 환자 74명을 대상으로 하였으며 구체적인 선정기준은 다음과 같다.
첫째, 본 연구의 목적을 이해하고 연구 참여에 동의한 자
둘째, 40세 이상 성인환자로 대장암으로 전신마취 하 복강경 대장절제술을 받는 자
셋째, 미국 마취과학회(American Society of Anesthesiology, ASA) 신체분류 등급 I 또는 II에 해당되는 자
그러나 체온에 영향을 미치는 약물(clonidine, phenothiazine, meperidine 계)의 투약, 체온조절에 영향을 미치는 갑상선 질환[29] 또는 이산화탄소 체외배출에 위험이 있는 폐쇄성 폐질환이나 심장질환이 있는 환자[5], 그리고 수술 중 수혈을 받는 자는 연구대상에서 제외시켰다.
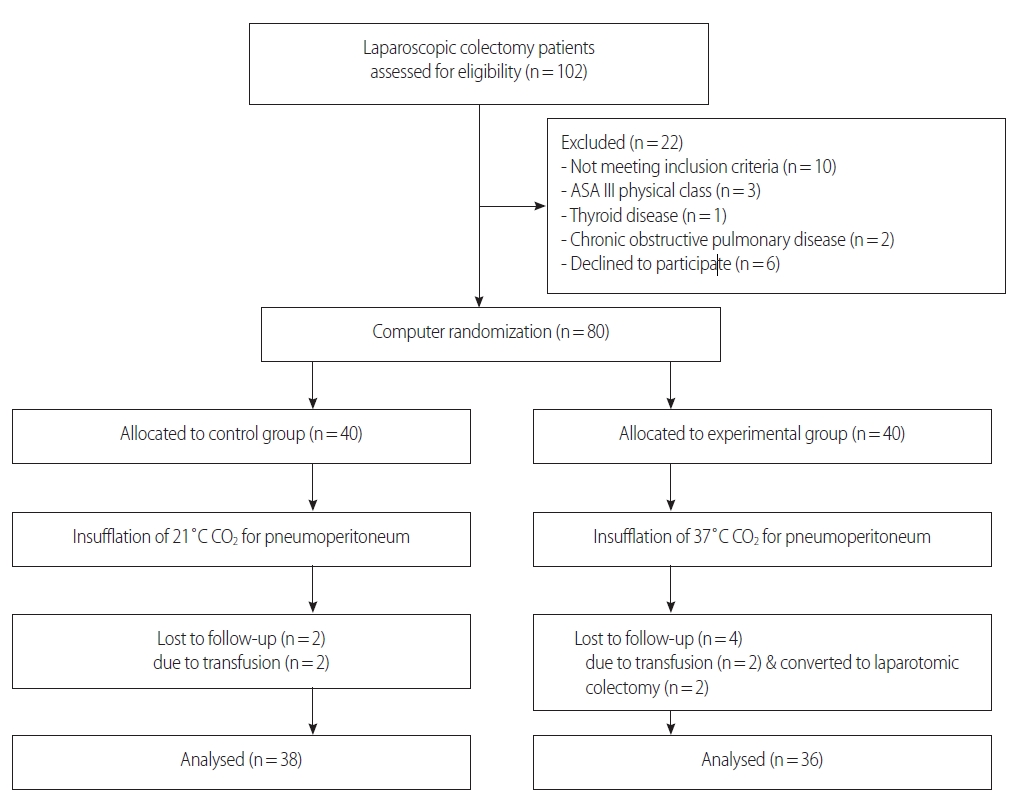
본 연구에서의 표본수는 G-Power 3.1을 이용하여 산정하였으며 선행연구[6,15]를 토대로 효과크기를 0.41-0.43으로 추정하였다. 유의수준을 .05, 검정력을 80%, 그리고 효과크기를 .41로 추정할 경우 t-test를 위한 연구집단 간 표본수는 37명, .42로 추정할 경우 표본수는 35명이 되므로 본 연구에 필요한 연구대상자는 연구집단 당 36명, 총 72명으로 추정하였다. 탈락률 10%를 고려하여 80명의 연구대상자를 실험군과 대조군에 40명씩 배정하였으나 대조군에서 2명, 그리고 실험군에서 4명의 탈락자가 발생하여 총 74명의 대상자가 참여하였다(Figure 1). 대조군 중 2명이 수술 중 수혈을 받았고, 실험군 중 2명이 수술 중 수혈받았고 2명이 복강경 수술에서 개복술로 전환하여 연구대상자에서 탈락하였다.
3. 연구집단의 무작위화 배정
자료수집을 시작하기 전 연구자가 엑셀함수를 이용한 컴퓨터 무작위화법으로 80명의 연구대상자를 대조군 또는 실험군에 1:1 비율로 배정하고 80장의 봉투 겉면에 1번에서 80번까지 번호를 부여하고 각각의 봉투에 배정 군을 넣은 후 봉하여 서랍장에 보관해 두었다. 첫 번째 연구대상자는 1번의 봉투, 두 번째 연구대상자에게는 2번의 봉투, 80번째 연구대상자는 80번 봉투에 들어있는 실험처치를 제공하였다.
연구자는 수술환자가 수술실로 입실하기 전에 실험처치를 제공하는 연구보조자에게 연구대상자에 해당되는 봉투를 전해주면 봉투를 뜯고 집단 배정을 확인한 후 해당되는 실험처치를 하였으며 연구대상자에게 해당되는 연구 집단을 알려주지 않았다. 실험처치는 가온버튼을 누르는 단순한 업무로써 6개월 이상의 수술실 간호사가 제공하였고 결과변수는 연구자와 마취 및 회복실 근무경력 5년 이상의 간호사가 측정하였다. 마취실무영역과 수술실무영역은 대방포로 차단되어 있어 결과변수를 측정하는 마취회복 간호사들에게 연구대상자에 대한 실험처치가 노출되지 않았다.
4. 실험처치
수술실 근무경력 1년 이상 되는 3명의 수술실 간호사가 연구보조자로써 실험처치를 제공하였으며 실험처치 과정은 다음과 같다.
리도카인 0.5 mg/kg을 정맥주사한 후 프로포폴, 알펜타닐을 정맥 투여하여 마취유도를 한 후 의식이 소실되면 로큐로니움을 정맥 투여하여 근이완을 유도하고, 기관내 삽관을 하였다. 기관내 삽관 후 데스플로란 6-7%, 공기 1.5 L/min와 O2 1.5 L/min를 흡입시켜 전신마취를 유지하였다. 마취유도 후부터 수술종료 시까지 실험군과 대조군의 모든 연구대상자에게 가온가습교환 장치를 이용하여 41°C로 가온가습된 흡입마취가스를 투여하였다.
전신마취 하에 상온의 포비돈 아이오다인을 사용하여 복부의 피부소독을 한 후 부직포를 이용하여 방포를 한 후 외과의가 15번 knife를 이용하여 배꼽 아래의 복부 피부를 절개한 후 베레스침을 삽입하였다. 베레스침 삽입 후 모든 연구대상자의 베레스침과 CO2 line을 연결한 후 1 L/min로 복강내 CO2 가스 주입을 시작하면서 베레스침의 복강 내 삽입이 확인되면 연구보조자는 가스 주입기의 Hi-flow 버튼을 누르고 기복압력을 15 mmHg로 조정하였다. 그 후 실험군의 CO2 line에 가온케이블과 가스 주입기의 가온센서를 연결하여 37°C로 가온한 이산화탄소를 복강 내로 유입시켰으며, 대조군의 CO2 line을 통하여 가온하지 않은 21°C 이산화탄소를 복강 내로 유입시켰다.
기복압이 15 mmHg에 이르면 베레스침을 제거한 후 투관침으로 교체하고 투관침을 통해 대조군은 21°C 이산화탄소, 그리고 실험군은 37°C 가온 이산화탄소를 각각 수술이 종료될 때까지 지속적으로 복강내로 유입시켜 기복을 하였다. 수술이 종료되면 가스주입기의 작동을 중지시킨 후 투관침을 제거하였다.
5. 연구도구
주요 결과변수로 체온, 혈압 및 맥박과 산염기 균형 지수를 측정하였고 부가적 결과변수로 체중과 수술실 실내온도를 측정하였다. 결과변수 측정은 간호사로써 마취 회복실에서 5년 이상의 실무경력을 가지고 있는 3명의 연구보조자와 연구자에 의해 이루어졌다.
1) 체온
체온은 고막용 체온계(ThermoScan IRT-4520; Braun, Frankfurter, Germany)를 이용하여 측정하였고 측정오차를 최소화하기 위해 자료수집에 참여하는 연구보조자 3명을 대상으로 고막체온 측정법에 대한 교육을 하였다. 첫째, 고막체온계에 탐침커버를 끼운 후 측정자의 왼손으로 연구대상자의 오른쪽 귓바퀴를 후상방으로 잡아당기고, 둘째, 오른손으로 고막체온계의 측정부를 외이도에 밀착시킨 후 버튼을 누르고 ‘삐’ 소리가 난 후 화면에 나타난 수치를 취하도록 하였다. 셋째, 오른 쪽 귀에서 고막체온을 연속 2회 측정하여 높은 값을 취하였다.
2) 혈압 및 심박동수
혈압은 Cuff (CRITIKON Dura-cuff REF2753, GE, Helsinki, Finland)를 환자의 팔 상박에 감아 심장모니터(Datex-ohmeda, GE, Helsinki, Finland)를 이용하여 측정하였고, 심박동수는 Multi- link probe (Solar 8000, GE, Helsinki, Finland)를 환자의 손가락에 부착하여 모니터(Datex-ohmeda, GE, Helsinki, Finland)에 연결하여 측정하였다.
3) 산염기 균형
요골동맥 천자부에 적용한 Monitoring kit (PX 260 Edwards, CIA Medical, IL,USA)로부터 1 mL의 동맥혈을 채취하여 동맥혈 가스분석기(Gem premier 3000, Instrumentation Laboratory, MA, USA)로 pH, PaCO2와 중탄산 이온(HCO3-)을 측정하였다.
4) 체중
신장 및 체중은 자동신장계(DS-103, Dongsahn Jenix, Seoul, Korea)와 체중계 (DB-1, CAS, Yangju, Korea)로 측정하였다.
5) 수술실 온도 및 습도
수술실에 설치되어 있는 온도/습도 측정계(HTC-1, Living & Home, Shenzhen, China)를 사용하여 측정하였다.
6. 윤리적 고려
자료 수집을 시작하기 전 해당 의료기관의 임상시험심사위원회(IRB No: GIRBA 2669-2012)의 승인을 받았다. 환자들에게 연구목적, 실험처치, 결과변수 측정과 기복가스의 가온요법을 설명한 후 연구대상자로 참여하게 되면 무작위화를 통해 대조군 또는 실험군에 배정되며 대조군에 배정되면 21°C 기복가스, 그리고 실험군에 배정되면 37°C 기복가스를 제공받게 됨을 설명하였다. 연구대상자로의 참여를 동의한 후에도 자유의사에 따라 참여 동의를 철회할 수 있음을 설명하였다. 질문에 상세히 응답해 주었고 연구대상자로 참여의사를 밝힌 후 서면동의서에 서명을 받았다.
7. 자료수집 절차
본 연구의 자료 수집은 2012년 2월 11일에서 9월 30일까지 이루어졌으며 자료수집 절차는 다음과 같다(Table 1).
수술 전날 마취 전 환자 평가가 끝나면 연구목적과 연구방법을 설명하고 연구 참여에 대해 서면동의서를 받은 후 성, 나이, ASA 신체등급, 체중과 신장 등의 자료를 수집하였다. 수술실 입실 후 실험군과 대조군의 모든 연구대상자에게 38°C로 조정한 전기순환 물담요(Blanketrol II, Cincinnati sub-zero Products Inc, OH, USA)를 등 아래에 적용해 주었다. 또한 8-12 mL/㎏/hr의 하트만 수액을 38°C로 가온시킨 후(REF HL-90, Smith Industries Medical System, MN, U.S.A) 20 gtt로 투여하기 시작하여 수술종료 시까지 투여하였다. 요골동맥을 천자하고 monitoring kit를 연결시킨 후 기준자료(Time 1)로써 마취유도 전 고막체온, 혈압 및 심박수를 측정하고, 요골동맥에서 1 mL의 동맥혈을 채취하여 동맥혈 가스분석을 하였다.
수술실 실내 온도와 습도를 측정하였고 기복 후 30분(Time 2), 90분(Time 3)에 고막체온, 혈압, 심박동수와 동맥혈 가스분석을 하였다. 수술이 종료되면 가스주입기의 작동 버튼을 끄고 기복시간을 기록하였다. 회복실 입실 후 30분(Time 4)에 고막체온, 혈압, 심박동수와 동맥혈 가스분석을 하였으며 수술실 온도는 22-24°C, 습도는 30-50%로 유지하였고, 모든 수술은 동일한 수술실에서 진행하였다.
8. 자료 분석
SPSS 통계프로그램(Version 19.0)을 이용하여 수집된 자료를 분석하였고 실험군과 대조군 간의 일반적 특성에 대한 동질성 검증은 t-test와 chi-square test로 분석하였다. 마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분 시점에서 실험군과 대조군 간의 심부체온, 혈압 및 심박수와 산염기 균형의 차이는 Repeated Measures ANOVA로 분석하였고 사후검정으로 집단 간 다중비교는 t-test, 시점 간 다중비교는 Bonferroni 분석법을 이용하였다.
연구 결과
1. 일반적 특성에 대한 동질성 검증
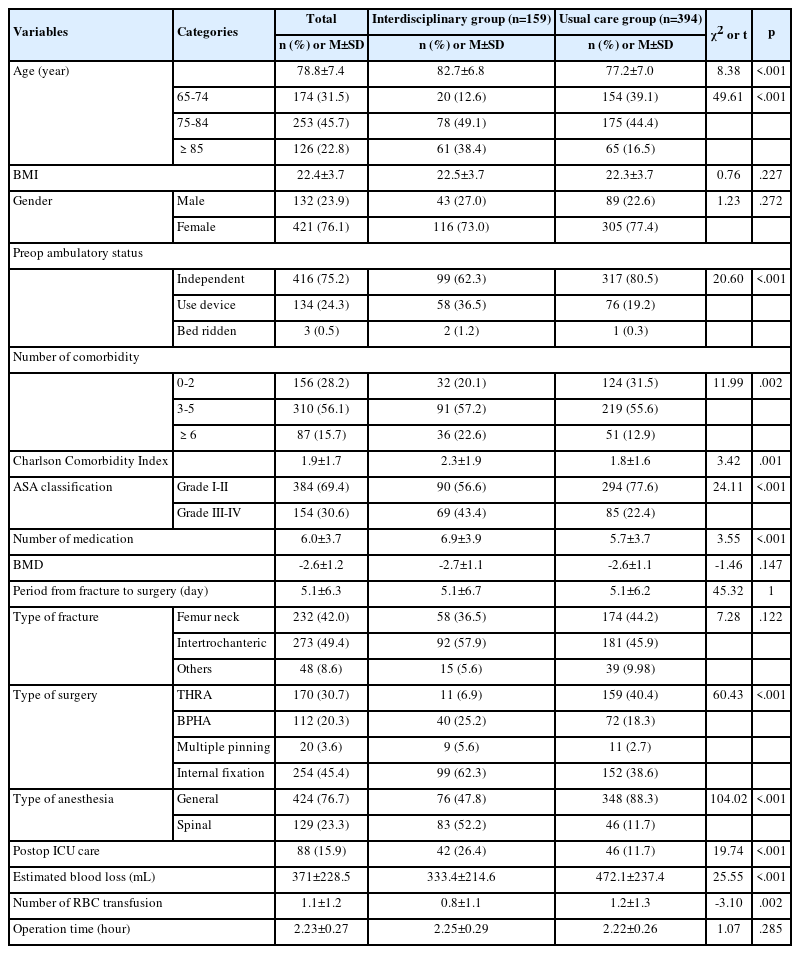
대조군과 실험군간의 동질성 검증결과는 Table 2에 제시하였다. 대조군과 실험군 간에 나이, 체중, 성별 분포, 진단명, 수술유형과 ASA 신체등급은 유의한 차이가 없는 것으로 나타났다. 또한 대조군과 실험군 간에 마취유도 전 체온, pH, PaCO2와 HCO3-, 수술 중 투여 수액량, 마취소요시간, 기복시간, 수술실 실내온도와 상대습도는 유의한 차이가 없는 것으로 나타났다.
2. 체온, 심박수 및 혈압 비교
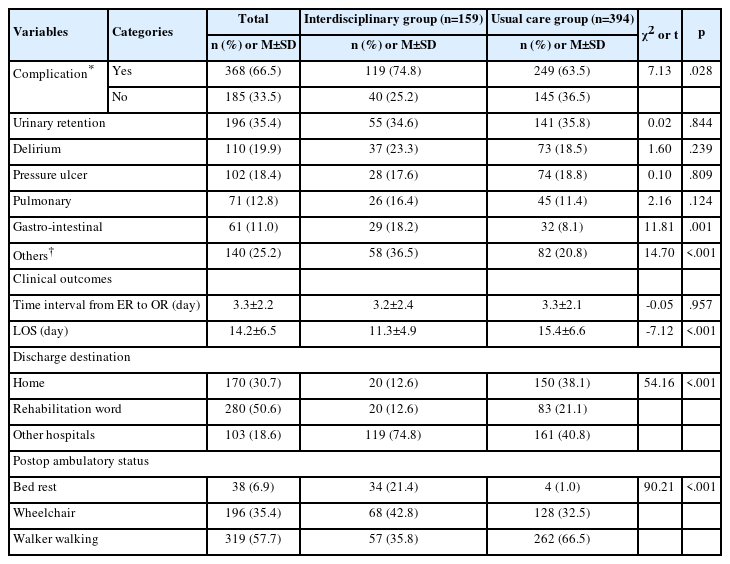
마취유도 전, 기복 후 30분, 기복 후 90분과 회복실 입실 후 30분 시점에서 대조군과 실험군 간의 체온, 심박수와 혈압 비교는 Table 3에 제시되어 있다.
Comparisons of Core Body Temperature, Systolic Blood Pressure and Heart Rate between Experimental and Control Groups (N=74)
대조군과 실험군 간의 체온은 통계적으로 유의한 차이가 있으며 (F=17.5, p<.001), 실험군의 체온은 대조군보다 기복 후 90분(p<.05)과 회복실 입실 후 30분(p<.05)에 각각 0.21°C와 0.33°C 높은 것으로 나타났다. 마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분에 반복 측정한 체온은 통계적으로 유의한 차이가 있는 것으로 나타났다 (F=613.7, p<.001). Bonferroni 다중비교 결과 마취유도 직전과 비교하여 기복 후 30분(p<.001), 기복 후 90분(p<.001), 그리고 회복실 입실 후 30분(p<.001)의 체온이 낮은 것으로 나타났다. 또한 실험군과 대조군 간에 마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분에 반복 측정한 체온의 변화 양상은 통계적으로 유의한 차이가 있어 교호작용은 유의한 것으로 나타났다(F=9.43, p<.001).
대조군과 실험군 간에 수축기 혈압은 유의한 차이가 없으나 (p=.558) 마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분에 반복 측정한 혈압은 통계적으로 유의한 차이가 있는 것으로 나타났다(F=37.7, p<.001). Bonferroni 다중비교 결과 마취유도 전과 비교하여 기복 후 30분(p<.001), 기복 후 90분(p<.001)에서 수축기압이 현저히 저하되나 회복실 입실 후 30분에서의 수축기압은 차이가 없는 것으로 나타났다. 또한 대조군과 실험군 간에 마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분에 반복 측정한 수축기 혈압의 변화 양상은 차이가 없어 교호작용은 통계적으로 유의하지 않은 것으로 나타났다(p=.895).
실험군과 대조군 간의 심박수는 통계적으로 유의한 차이가 없으나(p=.890), 마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분에 반복 측정한 맥박은 통계적으로 유의한 차이가 있는 것으로 나타났다(F=61.6, p<.001). Bonferroni 다중비교 결과 마취유도 전과 비교하여 기복 후 30분(p<.001), 기복 후 90분(p<.001)에서 심박동수가 감소되나 회복실 입실 후 30분(p<.01)에 심박동수가 증가하는 것으로 나타났다. 실험군과 대조군 간에 마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분에 반복 측정한 맥박의 변화 양상에는 차이가 없어 교호작용은 유의하지 않은 것으로 나타났다(p=.340).
3. 산염기 균형 비교
마취유도 전, 기복 후 30분, 기복 후 90분과 회복실 입실 후 30분 시점에서 대조군과 실험군 간의 산염기 균형 비교는 Table 4에 제시되어 있다.
대조군과 실험군 간에 pH는 유의한 차이가 있으며(F=7.49, p=.008), 실험군의 pH는 대조군과 비교하여 기복 후 90분(p<.05)에 저하된 것으로 나타났으나 기복 후 30분과 회복실 입실 후 30분에는 대조군과 차이가 없는 것으로 나타났다. 마취유도 전, 기복 후 30 분, 기복 후 90분 그리고 회복실 입실 후 30분에 반복 측정한 pH는 통계적으로 유의한 차이가 있는 것으로 나타났다(F=19.8, p<.001). Bonferroni 다중비교 결과 pH는 마취유도 전과 비교하여 기복 후 30분(p<.001), 기복 후 90분(p<.001), 그리고 회복실 입실 후 30분(p<.01)에 다소 낮아진 것으로 나타났다. 실험군과 대조군 간에 마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분에 반복 측정한 pH의 변화 양상에는 차이가 없어 교호작용은 유의하지 않은 것으로 나타났다(p=.231).
PaCO2는 대조군과 실험군 간 유의한 차이가 없으나(p=.171), 마취유도 전, 기복 후 30분, 기복 후 90분, 그리고 회복실 입실 후 30분에 반복 측정한 시점 간에 유의한 차이가 있는 것으로 나타났다(F=6.79, p<.001). Bonferroni 다중비교 결과 PaCO2는 마취유도 직전과 비교하여 기복 후 30분(p<.05), 기복 후 90분(p<.05), 그리고 회복실 입실 후 30분(p<.001)에서 낮은 것으로 나타났다. 반면 실험군과 대조군 간에 마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분에 반복 측정한 PaCO2의 시점간 변화 양상에는 차이가 없어 교호작용은 유의하지 않은 것으로 나타났다(p=.490).
대조군과 실험군 간의 HCO3-는 유의한 차이가 없으나(p=.891), 마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분에 반복 측정한 HCO3-는 통계적으로 유의한 차이가 있는 것으로 나타났다(F=21.16, p<.001). Bonferroni 다중비교 결과 HCO3-는 마취유도 전과 비교하여 기복 후 30분(p<.01), 기복 후 90분(p<.001), 그리고 회복실 입실 후 30분(p<.01)에 저하되는 것으로 나타났다. 반면 실험군과 대조군 간에 마취유도 전, 기복 후 30분, 기복 후 90분 그리고 회복실 입실 후 30분에 반복 측정한 HCO3-의 변화 양상에는 차이가 없어 교호작용은 유의하지 않은 것으로 나타났다(p=.768).
논 의
본 연구는 대장암으로 복강경 대장절제술을 받은 환자를 대상으로 기복제로 사용하는 이산화탄소의 37°C 가온이 체온, 혈역학 기능과 산염기 균형에 미치는 효과를 파악하여 복강경 수술 환자에 대한 간호실무의 근거자료를 제공하기 위하여 시도되었다.
본 연구에서 21°C 이산화탄소 기복은 물론 37°C 이산화탄소 기복 환자에게 모두 수술 중 전기담요와 수액가온기를 이용한 가온요법을 제공했음에도 기복 후 90분에 체온이 각각 1.3°C와 1°C 저하된 것으로 나타났다. 36°C 이하의 저체온에서 0.2°C 이상의 체온변화는 인체의 생리적 변화로써 중요한 임상적 의미를 가지고 있다는 점에서[29] 복강경 수술환자의 저체온에 대한 간호중재가 중요하다고 생각한다.
본 연구에서 37°C 가온 이산화탄소 기복은 21°C 이산화탄소 기복과 비교하여 기복 후 90분과 회복실 입실 후 30분에서의 체온을 0.21-0.33°C 상승시키는 효과가 있는 것으로 나타났다. 이러한 결과는 37°C의 이산화탄소 가온이 복강경 탈장성형술, 복강경 수술환자의 체온을 상승시킨 것으로 보고한 몇몇 선행연구에[2,4,18] 의해 지지되지만 이산화탄소 가온이 수술환자의 저체온 예방에 효과가 없는 것으로 보고한 일부 연구[10,15]와는 일치하고 있지 않다. 이산화탄소 가온이 수술환자의 저체온 예방에 효과가 없는 것으로 나타난 현상은 가온 이산화탄소 기복은 60분 이상 적용해야 효과가 나타나지만[22] 가온적용 시간이 60분 미만에 불과하고[21], 가온온도 가 각각 30.2°C와 36°C로 [20] 비교 효과가 나타나지 못하였을 가능성이 높다.
Sammour 등[15]은 19°C와 37°C 이산화탄소 기복 환자의 수술 시작 시 체온이 각각 35.9°C와 35.8°C이었으나 수술 종료 시 36.3°C와 36.4°C로 상승한 것으로 보고하며 복강경 수술에서 가온 이산화탄소 기복이 수술 중 체온유지에 효과가 없는 것으로 결론을 내리고 있다. 그러나 기복제 가온이 수술중 체온에 영향을 미치지 못한 것으로 나타난 위의 연구 결과는 강제공기가온 담요의 가온효과가 강력하며 기복제 이산화탄소의 가온효과를 은폐시켜 나타난 것으로 보인다. 다양한 가온요법을 적용한 수술에서 수술 종료 시 체온이 수술시작 시 체온보다 상승한 예는 거의 찾아 볼 수 없어 강제공기가온 담요의 가온효과에 대한 추후 연구가 필요하다고 생각한다.
본 연구에서 37°C 가온 이산화탄소와 21°C 이산화탄소 기복군의 회복실 도착 후 30분에서의 체온이 각각 36.2°C와 35.9°C로 기복제의 37°C 가온이 회복실 도착 후 정상체온 회복에 효과가 있는 것으로 나타난 현상은 Savel 등[4]의 연구에 의해 지지되고 있다. 본 연구와 몇몇 선행연구결과[4,15,18,21,22]를 고려할 때 기복제 이산화탄소의 37°C 가온은 60분 이상 적용할 때 수술 중 저체온 예방은 물론 수술 및 마취 종료 후 정상체온 회복에도 효과가 있는 것으로 보인다.
복강경 수술의 기복제로 사용하는 이산화탄소 가온이 혈압 및 심박동수 등의 혈역학 기능과 산염기 균형에 영향을 미치지 못한 것으로 나타난 본 연구의 결과는 몇몇 임상실험연구[21,22]에 의해 지지되고 있으나 Bashirov 등[19]의 연구결과와는 상반되어 있다. Bashirov 등[19]은 물질의 확산계수는 온도에 비례한다는 Fick’s diffusion law[28]를 기반으로 기복제 이산화탄소의 37°C 가온은 복막을 통한 이산화탄소 흡수를 증가시켜 혈역학 기능을 저하시키고 산염기 불균형을 초래한다고 주장하고 있지만 몇 가지 문제점이 있다. 첫째, Fick’s diffusion law에서 온도 상승으로 이산화탄소의 확산계수가 증가한다 하여도 기체 온도의 증가는 침투성 용해도를 저하시 키기 때문에[29] 이산화탄소의 체내 흡수가 증가하지 않는다는 점이다. 둘째, 압력이 일정할 때 기체의 부피는 온도의 증가에 비례한다는 샤를 법칙에 의하면 이산화탄소를 37°C로 가온할 경우 복강경 수술에 사용되는 이산화탄소량을 오히려 감소시킬 수 있다. 실제 복강경 대장절제술에서 기복제 37°C 가온 이산화탄소 사용량은 113 L인 반면 21°C 이산화탄소 사용량은 178 L [15]이며, 위절제술에서도 37°C 가온 이산화탄소 사용량은 162 L인 반면 21°C 이산화탄소 사용량은 200 L로[14] 37°C 가온 이산화탄소 기복이 21°C 이산화탄소 기복보다 이산화탄소 사용량이 오히려 적다는 사실도 Bashirov 등[19]의 주장에 무리가 있다는 것을 보여준다. 또한 Bashirov 등[19]의 연구는 돼지를 이용한 동물실험으로써 연구결과를 여과 없이 인간에게 적용하기에는 어려움이 있으며 또한 자료의 통계분석에 대한 구체적 설명이 없다는 아쉬움이 있다.
본 연구를 통해 기복제 이산화탄소의 37°C 가온은 수축기압 및 심박동수와 같은 혈역학 기능에 영향을 미치지 못한 것으로 보인다. 이산화탄소 기복 후 30분, 90분에 걸쳐 혈압 및 심박동수가 저하되지만 이러한 현상은 37°C 가온 이산화탄소와 21°C 이산화탄소 기복군 모두에게 공통적으로 나타난 현상으로 전신마취제 또는 레미펜타닐과 같은 마약성 약물 투여와 관련한 심혈관계 기능 저하와 관련이 높은 것으로[22,30] 보인다.
본 연구에서 기복제 이산화탄소의 37°C 가온이 pH, PaCO2와 HCO3-에 영향을 미치지 못한 것으로 나타난 현상은 Park [21], Lee 등[22]과 Kwack 등[30]의 연구결과와도 일치하지만 Bashirov등[19]의 연구결과와는 상반되어 있다. 본 연구의 결과는 복강경 수술에서 기복제 이산화탄소의 사용은 심장 및 폐질환과 같은 고위험 요인을 가지고 있지 않은 건강한 성인의 혈역학 기능 및 산염기 균형에 영향을 미치지 않는다는 선행연구에[24-26] 의해 지지되고 있다. 본 연구에서 기복 후 90분에 37°C 이산화탄소 기복군의 pH가 21°C 이산화탄소 기복군보다 다소 낮지만 정상적 상태로 산염기 균형에 영향을 미치는 것으로 간주하기는 어렵다. 37°C 이산화탄소 기복군과 21°C 이산화탄소 기복군 모두에서 기복 후 90분에 pH가 저하되고, PaCO2가 증가하며, HCO3-가 감소하지만 정상적 범위에서의 변화이며 수술 및 마취 종료 후 정상적인 산염기 균형을 회복하는 것으로 나타난 본 연구의 결과는 Park [21]과 Lee 등[22]의 선행연구 결과와도 일치한다.
본 연구의 제한점은 심부 체온으로 고막 체온을 측정하였다는 점이다. 심부체온으로 식도체온 또는 폐동맥 체온이 보다 안정적이지만 식도체온 및 폐동맥 체온의 측정은 전신마취 후에 가능하기 때문에 마취유도 전에는 식도체온 및 폐동맥 체온을 측정할 수 없기 때문이다. 이에 따라 본 연구에서는 심부체온으로 전신마취 유도 전과 마취종료 후에도 지속적으로 측정할 수 있는 고막체온을 측정하였다. 고막체온의 측정오차를 최소화하기 위해 연구보조자를 대상으로 고막체온 측정법을 교육하였다. 본 연구에서는 복강경 수술에 소요된 이산화탄소량을 측정하지 못하였으므로 가온 이산화탄소 기복과 21°C 이산화탄소 기복에서 이산화탄소의 소모량을 측정하는 추후연구를 제언한다.
결 론
본 연구를 통해 37°C의 이산화탄소 기복은 21°C의 이산화탄소 기복과 비교하여 복강경 수술 중 체온을 0.2-0.3°C 상승시키지만 수축기압, 심박동수, pH, PaCO2와 HCO3-에 영향을 미치지 못하는 것으로 나타났다. 따라서 ASA 신체등급 l 또는 ll 환자의 복강경 수술에서 기복제 이산화탄소를 37°C 로 가온하여 90분 이상 제공하는 것은 수술 중 혈역학 기능 저하 또는 산염기 불균형 초래와 같은 부작용 없이 심부 체온을 0.2-0.3°C 상승시키며 수술 종료 후 정상 체온 회복에 효과가 있는 것으로 결론을 내릴 수 있다. 그러나 기복제 이산화탄소의 가온에도 불구하고 수술중 저체온이 나타나므로 복강경 수술에서 저체온 예방을 위한 다양한 가온중재요법의 제공이 필요하다.